Основные положения протолитической теории кислот и оснований Бренстеда – Лоури.
Основные понятия термодинамики.
ТЕРМОДИНАМИЧЕСКАЯ СИТЕМА – любой объект природы, состоящий из достаточно большого числа молекул (структурных единиц) и отделенный от других объектов природы реальной или воображаемой границей. Объекты природы, не входящие в систему, называются СРЕДОЙ.
Общие характеристики системы: Масса вещества m и внутренняя энергия Е. Масса вещества системы определяется совокупностью масс молекул, из которых она состоит. Внутренняя энергия системысостоит из энергии теплового движения молекул и энергии взаимодействия между ними.
Системы по характеру обмена веществом и энергией с окружающей средой подразделяют на три типа:
1) Изолированные – те, которые не обмениваются с окружающей средой ни веществом, ни энергией (Δm=0, ΔE=0);
2) Закрытые – не обмениваются с окружающей средой веществом, но обмениваются энергией. (Δm=0, ΔE≠0);
3) Открытые – обмениваются с окружающей средой и веществом, и энергией (Δm≠0, ΔE≠0); пример открытой системы – живая клетка.
Обмен энергией может осуществляться передачей теплоты или совершением работы над системой.
Системы, в зависимости от агрегатного состояния вещества, из которого они состоят, подразделяются на гомогенные и гетерогенные: в гомогенной системе отсутствуют резкие изменения физических и химических свойств при переходе от одних областей системы к другим; гетерогенная система состоит из двух или более гомогенных частей.
Состояние системы – совокупность свойств системы, позволяющих определить систему с точки зрения термодинамики. Различают три состояния системы:
- равновесное (все свойства остаются постоянными в течении сколько угодно большого промежутка времени, нет потоков вещества и энергии);
- стационарное (свойства системы постоянны во времени, но есть потоки вещества и энергии);
- переходное состояние (свойства системы меняются во времени).
Состояние системы характеризуется определенной совокупностью химических величин, которые называются параметрам системы.
ПАРАМЕТРЫ:
1) ЭКСТЕНСИВНЫЕ (пропорциональны массе системы)
2) ИНТЕНСИВНЫЕ (не зависят от массы системы).
В термодинамике для определения изменения энергии системы в тех или иных условиях, применяют различные энергетические характеристики, называемые термодинамическими функциями состояния. Внутренняя энергия Е – одна из этих функций. Важная особенность функций состояния – их независимость от способов достижения данного состояния системы. Изменение внутренней энергии системы ΔЕ работой W, которая совершается при взаимодействии системы со средой и передачей теплоты Q между средой и системой. Переход системы из одного состояния в другое называется процессом.
Изобарный процесс – процесс, происходящий при постоянном давлении.
Изотермический – при постоянной температуре.
Изохорный – соответствует неизменному объему.
Функция состояния – некая функция, состоящая из нескольких независимых параметров, которые однозначно определяют состояние термодинамической системы.
Стандартные состояния – условно принятые состояния веществ и компонентов растворов при оценке термодинамических величин.
1) Первое начало термодинамики.
Приращение внутренней энергии ΔЕ в некотором процессе равно теплоте Q, полученной системой, плюс работа W, совершенная над системой в этом процессе.
ΔE=Q+W,
Энтальпия – термодинамическая функция (та энергия, которая доступна для преобразования в теплоту при определенном постоянном давлении).
Стандартная энтальпия образования – тепловой эффект реакции 1 моля вещества из простых веществ, его составляющих, находящихся в устойчивых стандартных состояниях.
Стандартная энтальпия сгорания – тепловой эффект реакции сгорания одного моля вещества в кислороде до образования оксидов в высшей степени окисления. Теплота сгорания негорючих веществ = 0.
Стандартная энтальпия нейтрализации – энтальпия реакции взаимодействия сильных кислот и оснований с образованием одного моля воды в стандартных условиях.
Энтальпия химической реакции – разность суммы энтальпий сгорания исходных веществ и суммы энтальпий сгорания продуктов с учетом стехиометрических коэффициентов
Закон Гесса: тепловой эффект химической реакции в изобарно-изотермических или изохорно-изотермических условиях зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от путей ее протекания (например, окисление глюкозы).
Следствия:
Закон Лавуазье-Лапласа: Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту прямой реакции.
1) Тепловой эффект химической реакции равен разности сумм теплот образования продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты:
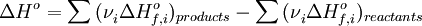
2) Тепловой эффект химической реакции равен разности сумм теплот сгорания исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты
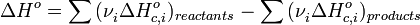
В 19 столетии было доказано экспериментально, что первый закон термодинамики применим к процессам, которые происходят в биологических системах.
Поступление пищи обеспечивает энергию, которая используется для выполнения различных функций организма или сохраняется для последующего использования. Энергия высвобождается из пищевых продуктов в процессе их биологического окисления, которое является многоступенчатым процессом.
Энергия пищевых продуктов используется в клетках первоначально для синтеза макроэргических соединений - например, аденозинтрифосфорной кислоты (ATФ). ATФ, в свою очередь, может использоваться как источник энергии почти для всех процессов в клетке.
Пищевые вещества окисляются вплоть до конечных продуктов, которые выделяются из организма. Например, углеводы окисляются в организме до углекислого газа и воды. Такие же конечные продукты образуются при сжигании углеводов в калориметре: C6H12O6+ 6O2= 6CO2+ 6H2O
Величина энергии, высвобождаемой из каждого грамма глюкозы в этой реакции, составляет 4,1 килокалории (ккал). Столько же энергии, образуется при окислении глюкозы в живых клетках, несмотря на то, что процесс окисления в них является многоступенчатым процессом и происходит в несколько стадий. Этот вывод основан на принципе Гесса, который является следствием первого закона термодинамики: тепловой эффект многоступенчатого химического процесса не зависит от его промежуточных этапов, а определяется лишь начальным и конечным состояниями системы.
Таким образом, исследования с помощью калориметра показали среднюю величину физиологически доступной энергии, которая содержится в 1грамме трех пищевых продуктов (в килокалориях): углеводы - 4,1; белки - 4,1; жиры - 9,3.
С другой стороны, в конечном итоге вся энергия, поступившая в организм, превращается в теплоту. Также при образовании АТФ лишь часть энергии запасается, большая - рассеивается в форме тепла. При использовании энергии ATФ функциональными системами организма большая часть этой энергии также переходит в тепловую.
Оставшаяся часть энергии в клетках идёт на выполнении ими функции, однако, в конечном счёте, превращается в теплоту. Например, энергия, используемая мышечными клетками, расходуется на преодоление вязкости мышцы и других тканей. Вязкое перемещение вызывает трение, что приводит к образованию тепла.
Другим примером является расход энергии, передаваемой сокращающимся сердцем крови. При течении крови по сосудам вся энергия превращается в тепло вследствие трения между слоями крови и между кровью и стенками сосудов.
Следовательно, по существу вся энергия, потраченная организмом, в конечном счете, преобразуется в теплоту. Из этого принципа существует лишь единственное исключение: в случае, когда мышцы выполняют работу над внешними телами.
Если человек не выполняет внешней работы, то уровень высвобождения организмом энергии можно определить по величине общего количества теплоты, выделенной телом. Для этого применяют метод прямой калориметрии, для реализации которого используют большой, специально оборудованный калориметр. Организм помещают в специальную камеру, которая хорошо изолирована от среды, то есть не происходит обмена энергией с окружающей камеру средой. Количество теплоты, выделенной исследуемым организмом, можно точно измерить. Эксперименты, выполненные этим методом, показали, что количество энергии, поступающей в организм, равно энергии, выделяющейся при проведении калориметрии.
Прямая калориметрия в проведении трудоёмка, поэтому в настоящее время используют метод непрямой калориметрии,который основаннавычислении энергетического выхода организма по использованию им кислорода.
3) Второе начало термодинамики.
Второй закон термодинамики определяет движущую силу самопроизвольно совершающихся процессов, в том числе химических реакций. Самопроизвольно могут проходить экзотермические химические реакции. Чем больше выделяется тепла, тем легче проходит реакция. ΔН>0. НО: самопроизвольно могут протекать не только экзотермические реакции (например, реакция растворения нитрата аммония). Самопроизвольный процесс, происходящий без изменения энергетического запаса системы совершается только в направлении, при котором система переходит в более вероятное состояние. Мерой является энтропия.
Энтропия характеризует меру беспорядка в системе.
S ∼ k·lnW
Приращение энтропии равно теплоте Qмин подведенной к системе в обратимом изотермическом процессе, деленной на абсолютную температуру Т, при которой осуществляется процесс.
ΔS=Qмин/T Дж/К
Приращение энтропии – экспериментально определяемая величина.
На основе энтропии можно прогнозировать направление самопроизвольного протекания процессов. Однако, она применяется как критерий направленности только к изолированным системам. Для неизолированных систем изменение энтропии, как и изменение внутренней энергии уже не является критерием самопроизвольности. В качестве такого критерия в закрытых и открытых системах вводится энергия Гиббса.
В химических процессах одновременно действуют два противоположных фактора — энтропийный ( 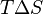 ) и энтальпийный (
) и энтальпийный ( 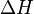 ). Суммарный эффект этих противоположных факторов в процессах, протекающих при постоянном давлении и температуре, определяет изменение энергии Гиббса (
). Суммарный эффект этих противоположных факторов в процессах, протекающих при постоянном давлении и температуре, определяет изменение энергии Гиббса ( 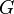 ):
):
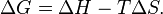
Из этого выражения следует, что 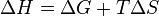 , то есть некоторое количество теплоты расходуется на увеличение энтропии (
, то есть некоторое количество теплоты расходуется на увеличение энтропии ( 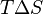 ), эта часть энергии потеряна для совершения полезной работы (рассеивается в окружающую среду в виде тепла), её часто называют связанной энергией. Другая часть теплоты (
), эта часть энергии потеряна для совершения полезной работы (рассеивается в окружающую среду в виде тепла), её часто называют связанной энергией. Другая часть теплоты ( 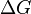 ) может быть использована для совершения работы, поэтому энергию Гиббса часто называют также свободной энергией.
) может быть использована для совершения работы, поэтому энергию Гиббса часто называют также свободной энергией.
Характер изменения энергии Гиббса позволяет судить о принципиальной возможности осуществления процесса. При 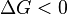 процесс может протекать, при
процесс может протекать, при 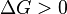 процесс протекать не может (иными словами, если энергия Гиббса в исходном состоянии системы больше, чем в конечном, то процесс принципиально может протекать, если наоборот — то не может). Если же
процесс протекать не может (иными словами, если энергия Гиббса в исходном состоянии системы больше, чем в конечном, то процесс принципиально может протекать, если наоборот — то не может). Если же 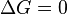 , то система находится в состоянии химического равновесия.
, то система находится в состоянии химического равновесия.
Направление самопроизвольно протекающих процессов определяют два фактора. Один из них – стремление к достижению минимума энергии (ее мерой является энтальпия). Другой фактор – стремление к неупорядоченному, хаотическому и вероятному состоянию. В химических системах эта тенденция проявляется в стремлении веществ к распаду на более простые и к равномерному рассеянию их по всему объему системы. Мерой этого стремления является изменение энтропии. Возможность самопроизвольно протекания любого процесса в каком-то определенном направлении зависит от того, какой из этих факторов окажется наиболее эффективным. Разность между энтальпийным и энтропийным факторами (ΔG=ΔH-TΔS) позволяет судить о возможности самопроизвольного протекания химического процесса в данном направлении.
На основе энергии Гиббса, второе начало термодинамики: В изобарно-изотермических условиях в системе самопроизвольно могут осуществляться только такие процессы, в результате которых энергия Гиббса системы меняется.
Если система находится в равновесии, это состояние поддерживается как угодно долго при неизменности внешних условий.
Процесс называют термодинамически обратимым, если при переходе из начального состояния 1 в конечное состояние 2 все промежуточные состояния оказываются равновесными.
Обратимый процесс на любом этапе можно заставить идти в обратном направлении, изменив внешние условия на очень малую величину.
Процесс называется термодинамически необратимым, если хоть одно из промежуточных состояний неравновесно.
4) Термодинамические условия равновесия.
| ТЕРМОДИНАМИЧЕСКОЕ РАВНОВЕСИЕ, состояние термодинамической. системы, не изменяющееся во времени и не сопровождающееся переносом через систему вещества или энергии. Если состояние системы не изменяется во времени, но есть поток вещества или энергии через систему, состояние системы называется стационарным. Изолированная система, не обменивающаяся со средой веществом и энергией, со временем всегда приходит к термодинамическому равновесию и не может самопроизвольно из него выйти. Постепенный переход системы из неравновесного состояния, вызванного внешним воздействием, в состояние термодинамического равновесия называется релаксацией. Термодинамическое равновесие включает: термическое равновесие - постоянство температуры в объеме системы, отсутствие градиентов температуры; механическое равновесие, при котором невозможны никакие макроскопические перемещения частей системы, т. е. имеется равенство давления в объеме системы; допустимы, однако, движения системы как целого – поступательное движение в поле действия внешних сил и вращение. В случае гетерогенной системы сосуществование термодинамически равновесных фаз называется фазовым равновесием. Если между компонентами системы происходят химические реакции, в состоянии термодинамического равновесия скорости прямых и обратных процессов равны между собой. При термодинамическом равновесии в системе прекращаются все необратимые процессы переноса (теплопроводность, диффузия, вязкое течение и т.п.). В системе не наблюдается изменение концентраций реагирующих веществ, для закрытой системы характерно равновесное распределение компонентов между составляющими систему фазами. Параметры состояния, определяющие термодинамическое равновесие, строго говоря, не являются постоянными, а флуктуируют около некоторых статистических средних значений; обычно эти флуктуации пренебрежимо малы. Термодинамические условия равновесия: ΔG=0 ΔH= TΔS Под стандартной энергией Гиббса образования ΔG°, понимают изменение энергии Гиббса при реакции образования 1 моль вещества, находящегося в стандартном состоянии. Это определение подразумевает, что стандартная энергия Гиббса образования простого вещества, устойчивого в стандартных условиях, равна нулю. Изменение энергии Гиббса не зависит от пути процесса, следовательно, можно получать разные неизвестные значения энергий Гиббса образования из уравнений, в которых с одной стороны записанны суммы энергий продуктов реакции, а с другой - суммы энергий исходных веществ. При пользовании значениями стандартной энергии Гиббса критерием принципиальной возможности процесса в нестандартных условиях принимается условие ΔG° <0, а критерием принципиальной невозможности — условие ΔG°> 0. В то же время, если стандартная энергия Гиббса равна нулю, это не означает, что в реальных условиях (отличных от стандартных) система будет в равновесии. |
5) Предмет и основные понятия химической кинетики.
Химическая кинетика – раздел физической химии, посвященный изучению скоростей и механизмов химических реакций.
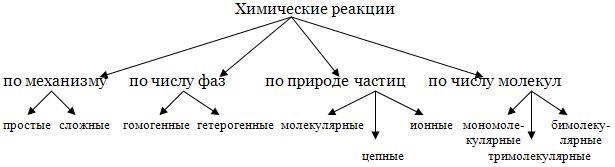
По механизму химические реакции делят на простые и сложные. К простым относятся реакции, которые протекают только в одну стадию. Например, разложение галогенов: I2 = 2I. Если же реакция протекает в несколько стадий, то она является сложной. Например, реакция разложения пероксида водорода записывается суммарным уравнением:
2Н2О2 = 2Н2О + О2
Однако эта реакция протекает в две стадии и является сложной:
1) Н2О2 = Н2О + О
2) О + О = О2.
Сложные реакции в свою очередь делят на последовательные, параллельные и сопряженные. Последовательные - реакции с промежуточными стадиями типа А → В → С. Параллельные - исходные вещества реагируют сразу в нескольких направлениях: 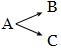
Например, 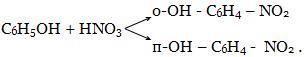
Сопряженные - реакции, из которых одна протекает лишь совместно с другой. Например, Н2О2 легко окисляет соединения железа, но практически не окисляет бензол. Однако если провести эти реакции в общей смеси, то Н2О2 в этом случае окисляет и бензол:
Fe2+ + H2O2 = Fe3+ + OH-
OH- + OH- + C6H6 = C6H5OH + H2O.
По числу фаз химические реакции делят на гомогенные - протекают в одной фазе и гетерогенные - протекают на границе раздела фаз.
По природе частиц реакции делят на молекулярные (реагируют молекулы), ионные (реакции между ионами) и цепные. В последнем случае участвуют атомы и радикалы.
В основе классификации по числу частиц лежит молекулярность реакции - это минимальное число молекул, принимающих участие в акте химического взаимодействия. Выделяют мономолекулярные, бимолекулярные и тримолекулярные.
Для того, чтобы молекулы прореагировали, они должны сблизиться на расстояние порядка атомных размеров, когда электроны атомов одной молекулы попадут в сферу действия электронов атомов другой молекулы. Такое сближение молекул называют столкновением. Но не при любом столкновении молекулы взаимодействуют. Столкновения, при которых молекулы реагируют, называют элементарными актами.
Скоростью химической реакции называют количество элементарных актов реакции, совершающихся в единицу времени.
Скорость химических реакций варьирует в широких пределах (от десятимиллионных долей секунды при взрыве тротила или нитроглицерина до миллионов лет в случае образования каменного угля из древесины).
Под скоростью химической реакции понимают число элементарных актов реакции в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности раздела фаз (для гетерогенных реакций).
Для определения скорости реакции достаточно знать изменение концентрации во времени только одного из участвующих в реакции веществ, причем безразлично какого вещества - исходного или конечного. Различают среднюю и истинную скорость реакции. Средней скоростью реакции называют отношение изменения концентрации вещества (уменьшения концентрации исходного вещества или увеличение концентрации продукта реакции) к промежутку времени, в течение которого это изменение произошло:
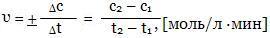
Скорость реакции всегда считается величиной положительной, но отношение Δc/Δt может быть отрицательным, если υ изучается по изменению концентрации исходных веществ.
Чем ближе сдвигаются между собой t1 и t2, тем меньше становится Δt и Δc. Тогда отношение Δc/Δt все больше приближается к значению истинной скорости. Предельная величина Δc/Δt, когда Δt стремится к нулю как к своему пределу (Δt → 0), называется истинной скоростью химической реакции:
υ = lim (± Δc/Δt) = ± dc/dt,
где dc/dt - производная от концентрации по времени. Истинную скорость еще называют мгновенной скоростью реакции, т.е. скорость в данный момент времени.
6) Кинетические уравнения.
КИНЕТИЧЕСКОЕ УРАВНЕНИЕ, выражает зависимость скорости химической реакции от концентраций компонентов реакционной смеси. Для простой (одностадийной) гомогенной реакции скорость v пропорциональна произведению концентраций реагирующих веществ и кинетическое уравнение записывается в виде:
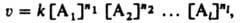
где [Ai] (i=1,2,...,l) - концентрация i-го вещества, ni-порядок реакции по i-му веществу, k-константа скорости реакции.
Закон действующих масс: при постоянной температуре скорость химической реакции в данный момент пропорциональна произведению молярных концентраций реагирующих веществ. Для простой тримолекулярной реакции
2NO + O2 = 2NO2
υ = k · [NO]2 [O2],
где k - константа скорости реакции.
Таким образом, в математическом выражении закона действующих масс для всех простых гомогенных реакций каждая из концентраций реагирующих веществ входит в степени, равной коэффициенту перед формулой данного вещества в уравнении реакции.
Эти степени называют частными порядками по веществу, а сумма их называется полным порядком. Эта реакция имеет первый порядок по О2 и второй порядок по NO. Полный ее порядок будет равен 3. Кинетический порядок может иметь значения от 0 до 3, включая дробные числа.
Порядок реакции совпадает с ее молекулярностью только в случае простых реакций. А для сложных реакций частные порядки по веществам, участвующим в реакции и дающие в сумме полный порядок, находятся экспериментальным путем. В общем случае для сложной реакции
аА + вВ = сС + дД
υ = k · [А]m [В]n .
m + n - общий порядок реакции. m и n в большинстве случаев не равны стехиометрическим коэффициентам.
Объясняется это тем, что сложные реакции идут через ряд последовательных мономолекулярных и бимолекулярных промежуточных стадий с разными скоростями. Общая скорость сложной реакции и ее кинетическое уравнение будут определяться самой медленной стадией, которая называется лимитирующей.
Порядок реакции определяет характер зависимости скорости реакции от концентрации реагирующих веществ. И зная порядок реакции, можно сделать некоторые предположения о механизме ее протекания.
К реакциям 1 порядка относится ряд мономолекулярных реакций распада и изомеризации сложных молекул в газах и растворах, разложение эфиров, реакции радиоактивного распада атомных ядер, многие бимолекулярные реакции при условии, что концентрация одного из реагирующих веществ поддерживается постоянной (например, реакции гидролиза при большом избытке воды).
Все реакции 1 порядка подчиняются кинетическому уравнению для мономолекулярных реакций - независимо от того, какую молекулярность они имеют:
υ = k · [А].
Если начальная концентрация вещества А равна а моль/л, а за время t прореагировало этого вещества х моль/л, то в данный момент времени концентрация вещества А стала а - х моль/л.
К реакциям II порядка относятся многие бимолекулярные и тримолекулярные реакции. Кинетическое уравнение для них имеет вид
υ = k · [А] · [В].
Реакции нулевого порядка встречаются главным образом среди гетерогенных реакций, у которых скорость стадий зависит от диффузии фаз. Примером может служить разложение йодоводорода на поверхности золота или разложение аммиака на поверхности вольфрама или молибдена.
υ = k · [А]0 = k, т.к. [А]0 = 1, υ = const.
Дробный порядок возможен в том случае, если механизм реакции имеет многостадийный характер, причем самых медленных стадий окажется несколько, или лимитирующая стадия окажется обратимой. Пример - реакция превращения о-водорода в п-водород (в молекуле ортоводорода спины ядер атомов параллельны, а в молекуле параводорода - антипараллельны):
о-Н2 + Н = п-Н2 + Н.
Итак, разница между порядком химической реакции и ее молекулярностью состоит в том, что порядок относится к кинетическому уравнению, описывающему скорость реакции, а молекулярность - к ее механизму и показывает, сколько молекул участвует в элементарном акте взаимодействия.
Определение порядка реакции очень важно для изучения ее механизма. Из многих методов определения порядка реакции наиболее распространены:
1) метод изолирования (метод Оствальда) - сначала определяют частные порядки реакции по каждому веществу, затем - общий порядок суммированием частных порядков;
2) метод подбора уравнений - экспериментальные данные по изменению концентрации реагирующего вещества в ходе опыта через определенные промежутки времени подставляют в уравнения константы скорости реакции разных порядков. Порядок реакции по данному веществу будет соответствовать тому кинетическому уравнению, которое даст при заданной температуре постоянное значение величины константы скорости реакции в различные моменты времени.
Период полупревращения - это время, необходимое для того, чтобы исходная концентрация реагента уменьшилась вдвое.
7) Зависимость скорости химической реакции от температуры.
Влияние температуры на скорость химической реакции.
В 1884 г. Я.Г. Вант-Гофф эмпирически установил правило, согласно которому при повышении температуры на каждые 10°С скорость химической реакции увеличивается в 2-4 раза. Это правило может быть использовано для приблизительной характеристики влияния температуры на скорость химической реакции в небольшом интервале температур.
При повышении температуры концентрации реагирующих веществ меняются сравнительно мало. Поэтому в кинетическом уравнении
υ = k · [А] · [В].
влияние температуры будет практически сказываться только на изменении К. Это влияние характеризуется температурным коэффициентом скорости реакции γ, который равен отношению константы скорости реакции при температуре t + 10 к константе скорости при температуре t:
γ = kt+10 / kt
Через скорость:
υ2/υ1 = γ(t2 - t1) / 10
Например, известно, что при нагревании газа с 30° до 60° С скорость реакции увеличилась в 8 раз. Следовательно, согласно правилу Вант-Гоффа
8 = γ(60 - 30) /10 = γ3;
γ = 2.
правило Вант-Гоффа применимо только для реакций с энергией активации 60-120 кДж/моль в температурном диапазоне 10-400oC. Правилу Вант-Гоффа также не подчиняются реакции, в которых принимают участие громоздкие молекулы, например, белки в биологических системах. Но кинетическая теория не в состоянии объяснить причину быстрого роста скорости химической реакции с повышением температуры, так как не каждое соударение молекул приводит к взаимодействию. В связи с этим кинетические представления были пополнены теорией активации.
Энергия активации (Е, [Дж/моль]) - это минимальная энергия, которой должны обладать реагирующие частицы, чтобы столкновения между ними приводили к химическому взаимодействию. Зависимость k скорости реакции и Е отражает уравнение Аррениуса:
lg k = lgA - E/2,3 · R · T,
где А - константа Аррениуса, характеризующая конкретную реакцию. Находится графическим методом зависимости lg k= f (1/T). tg угла наклона к оси абсцисс дает величину Е/2,3 · R · T.
Стерические факторы — пространственные затруднения (реже пространственные содействия) химическому взаимодействию двух реагирующих веществ, возникающих вследствие появления объёмистых заместителей вокруг реакционного центра или создания вокруг него таких структурных образований (из молекул белков, липидов и т. д.), которые одним реагентам закрывают, а другим открывают доступ к реакционному центру.
Особенно важна роль стерических факторов в биохимических процессах, а также в химии полимеров.
Суть теории переходного состояния (активированного комплекса):
1)частицы реагентов при взаимодействии теряют свою кинетическую энергию, которая превращается в потенциальную, и для того чтобы реакция свершилась, необходимо преодолеть некий барьер потенциальной энергии;
2) разница между потенциальной энергией частиц и упомянутым энергетическим барьером и есть энергия активации;
3) переходное состояние находится в равновесии с реагентами;
4) в тех реакциях, где энергия активации существенно ниже энергии разрыва химических связей, процессы образования новых связей и разрушения старых связей могут полностью или частично совпадать по времени.
8) Катализ.
Катализаторы –вещества, которые, будучи введенными в систему, резко изменяют скорость реакции, оставаясь при этом в химически неизменном виде.
Если катализатор находится в той же фазе, что и реагирующие вещества, то такой катализ называют гомогенным, если же катализатор и реагирующие вещества находятся в разных фазах – гетерогенным.
Энергетический профиль каталитической реакции- это кривая зависимость координаты реакции (насколько прошла реакция) от времени (при постоянном количестве катализатора) или от количества катализатора.
Ферменты ускоряют как прямую, так и обратную реакцию, понижая энергию активации процесса. Химическое равновесие при этом не смещается ни в прямую, ни в обратную сторону. Отличительной особенностью ферментов по сравнению с небелковыми катализаторами является их высокая специфичность — константа связывания некоторых субстратов с белком может достигать 10−10 моль/л и менее. Каждая молекула фермента способна выполнять от нескольких тысяч до нескольких миллионов «операций» в секунду. Ферменты обладают огромной каталитической активностью: они способны ускорять реакции в 1014—1015 (миллион миллиардов) раз (а многие ферментативные реакции в отсутствие ферментов просто не идут), они чувствительны к кислотности среды. Каждый фермент работает только в узком интервале рН (пепсин желудочного сока действует при рН 2—3). Ферменты действуют при относительно низкой температуре.
9) Химическое равновесие.
Химическое равновесие — состояние химической системы, в котором протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.
Обратимые и необратимые реакции
Все химическое реакции можно подразделить на 2 группы: обратимые и необратимые.
Необратимые – это реакции, протекающие до конца, т.е. до полного израсходования одного из реагирующих веществ.
Обратимыми – называются реакции, которые могут протекать в рассматриваемых условиях как в прямом, так и обратном направлениях.
Реакция, протекающая слева направо, называется прямой, а справа налево – обратной.
Соотношение, определяемое равенством называется выражением константы равновесия или законом действия масс. Равенство характеризует предел, до которого может изменяться состав реакционной смеси. Таким образом, в условиях химического равновесия концентрации всех веществ, участвующих в реакции, связаны между собой и нельзя изменить ни одной из без того, чтобы это не повлекло за собой изменения концентрации всех остальных веществ. Соотношение между концентрациями, выражаемое константой равновесия, сохраняет постоянной для данной t˚ значение.
Для реакции:
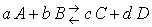
Константа равновесия выражается равенством:
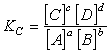
Термодинамические условия равновесия:
ΔG=0
ΔH= TΔS
Зависимость константы равновесия реакции от температуры может быть описана уравнением изобары химической реакции (изобары Вант-Гоффа):
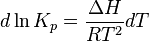
Изотерма химической реакции.
Предположим, что что все участвующие в реакции химические вещества A, B, M, N– идеальны газы. Пусть в начальном состоянии системы давление было представлено суммой парциальных давлений A и B (pA+pB), а в конечном состоянии – суммой парциальных давлений продуктов реакции M и N (pM+pN). Парциальное давление – та часть общего давления, производимого газовой смесью, которая приходится на долю данного газа; оно равно давлению, которое производил бы данный газ если бы он сам занимал весь объем, предоставленный газовой смеси). Выражение, связывающее величину изменения энергии Гиббса данной реакции при Т=const и р=const со значением константы равновесия К
ΔG= -RT ln Kp + RT ln PMm PNn/PAaPBb – уравнение изотермы реакции.
При изменении равновесных концентраций исходных веществ и продуктов реакции путем воздействия на систему происходит смещение химического равновесия. Если увеличиваются равновесные концентрации продуктов реакции, то говорят о смещении равновесия вправо. Если при внешнем воздействии увеличиваются концентрации исходных веществ, то говорят о смещении равновесия влево.
Характер смещения равновесия можно прогнозировать, применяя принцип Ле Шателье:
если на систему, находящуюся в равновесии, оказывается внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет внешнее воздействие.
Принцип Ле Шателье следует из закона действующих масс. Если система находится при постоянной температуре, то константа равновесия при внешних воздействиях остается постоянной. Поэтому любое изменение равновесных концентраций веществ должно приводить к такому изменению равновесных концентраций других веществ, чтобы соблюдалось постоянство константы равновесия.
Согласно теореме Пригожина, в каждой предоставленной самой себе линейной открытой системе (линейной называется система, в которой между «потоками» и вызывающими их «силами» существуют линейные соотношения; таков, например, закон Ома) прирост энтропии при постоянных во времени условиях уменьшается до тех пор, пока он не достигнет минимума в стационарном состоянии динамического равновесия. diS/dt=min. Теорема о минимуме производства энтропии в стационарном неравновесном состоянии отражает внутреннюю устойчивость неравновесных систем, ее своеобразную инерционность.
Устойчивость стационарных состояний с минимальным производством энтропии связана с принципом Ле Шателье - Брауна в современном изложении он означает, что система, выведенная внешним воздействием из состояния с минимальным производством энтропии, стимулирует развитие процессов, направленных на ослабление внешнего воздействия.
Каждый живой организм и каждая клетка представляет собой термодинамическую открытую систему, которая непрерывно превращает заключенную в органических веществах потенциальную химическую энергию в энергию рабочих процессов и в конце концов отдает ее в окружающую среду в форме тепла. В результате этого обмена веществом и энергией с окружающей средой между средой и живой системой нет термодинамического равновесия. «Живая система никогда не находится в равновесии и все время совершает за счет своей свободной энергии работу против равновесия, устанавливающегося при данных внешних условиях («всеобщий закон биологии», Бауэр, 1935).При температурах, свойственных живому организму, его структуры лабильны и подвергаются непрерывному распаду. Для компенсация этого распада должна совершаться «внутренняя работа» в форме процессов синтеза. Иными словами, рабочие процессы являются процессами с отрицательной энтропией (негэнтропийными процессами), так как они противодействуют увеличению энтропии, связанному с распадом структур; они создают упорядоченность с помощью химической энергии и низкой энтропии поглощаемых высокоструктурированных органических веществ (гетеротрофные организмы) или с помощью электромагнитной энергии и низкой энтропии поглощаемого солнечного света (автотрофные зеленые растения). Прекращение этого процесса означает потерю структурности, смерть. Труп переходит в состояние термодинамического равновесия с максимальной энтропией.
У гетеротрофных организмов поглощаемые пищевые вещества обладают большей степенью упорядоченности (меньшей энтропией), чем выделяемые продукты обмена веществ. В живом организме deS/dt<0. Организмы используют «деградацию» этих веществ, они питаются «отрицательной энтропией» (Шрёдингер) переносят упорядоченность (отрицательную энтропию!) из питательных веществ в самих себя. Обмен веществ с точки зрения термодинамики необходим для того, чтобы препятствовать увеличению энтропии, обусловленному необратимыми процессами в системе. Для системы «живой организм + окружающая среда» (среда, из которой берутся питательные вещества и которой отдаются продукты обмена) второй закон термодинамики действителен в своей классической форме, т. е ее энтропия возрастает и никогда не уменьшается. Таким образом, живые организмы могут создавать внутри себя упорядоченность только за счет того, что они уменьшают упорядоченность в окружающей их среде. Эмбриональное развитие животного, связанное с процессами дифференцировки, происходит с приростом удельного производства энтропии (на единицу массы организма). Поэтому теорема Пригожина здесь неприменима. Напротив, во время постнатального периода роста, в соответствии с теоремой Пригожина, удельное производство энтропии все время уменьшается до тех пор, пока у взрослого животного, у которого масса тела постоянна, не установится стационарное состояние с минимальным производством энтропии. У многолетних растений, у которых процессы дифференцировки и роста происходят в течение всей жизни, дело обстоит иначе. Конечно, живые организмы существуют не только за счет отрицательной энтропии, но и за счет положительной энергии. В стационарном состоянии содержание внутренней энергии в системе также постоянно и не зависит от времени. Любая потеря внутренней энергии при осуществлении внешней работы или отдаче тепла должна быть компенсирована соответствующим притоком энергии.
(на счет выделенного серым не уверена).
10. Вода играет уникальную роль как вещество, определяющее возможность существования и саму жизнь всех существ на Земле. Она выполняет роль универсального растворителя, в котором происходят основные биохимические процессы живых организмов. Уникальность воды состоит в том, что она достаточно хорошо растворяет как органические, так и неорганические вещества, обеспечивая высокую скорость протекания химических реакций и в то же время — достаточную сложность образующихся комплексных соединений.
Благодаря водородной связи, вода остаётся жидкой в широком диапазоне температур, причём именно в том, который широко представлен на планете Земля в настоящее время.
Вода в качестве реагента участвует во многих химических реакциях:
·В ходе фотосинтеза у растений происходит фотолиз воды - водород из состава воды входит в органические вещества, а свободный кислород выделяется в атмосферу.
Уравнение фотосинтеза:
6H2O+6CO2=C6H12O6+ 6O2
·Вода участвует в гидролизе — разрушении веществ с присоединением воды. Например, гидролиз жиров, белков и углеводов происходит при переваривании пищи, а при гидролизе АТФ выделяется энергия, обеспечивающая нужды клетки.
·При гидролизе солей вода является источником протонов и электронов.
Растворы и сам процесс растворения имеют большое значение в природе, в нашей жизни, в науке и технике. Чаще всего мы имеем дело не с чистыми веществами, а со смесями или растворами. Вода морей, рек, озер, грунтовые воды, питьевая вода - это растворы. Воздух - это раствор газов. Большинство минералов - твердые растворы. Соки растений, напитки - это растворы. Усвоение пищи связано с растворением питательных веществ. Растворами есть кровь, лимфа, лекарства, лаки, краски. Растворы используются в промышленности: текстильной, металлообрабатывающей, фармацевтической, при производстве пластмасс, синтетических волокон, мыла и др..
При растворении веществ происходит их дробление и рассеивание в объеме раствора. В растворе частицы одного вещества равномерно распределены между частицами другой. Если вещество растворено до уровня молекул, то раствор будет однородным, прозрачным и не будет отстаиваться. Такой раствор является истинным. Например, раствор соли в воде, столовый уксус, раствор сахара. Характерный признак истинных растворов - их однородность.
Растворами называют многокомпонентные однородные системы переменного состава.
В растворе всегда содержатся растворитель и растворенное вещество.
Вода широко используется в качестве растворителя в химической технологии, а также в лабораторной практике. Она представляет собой универсальный растворитель, необходимый для протекания биохимических реакций. Дело в том, что вода прекрасно растворяет ионные соединения, а также многие ковалентные соединения. Способность воды хорошо растворять многие вещества обусловлена полярностью ее молекул. Молекула воды обладает сравнительно большим дипольным моментом. Поэтому при растворении в ней ионных веществ молекулы воды ориентируются вокруг ионов, т.е. сольватируют их. Водные растворы ионных веществ являются электролитами.
Растворимость ковалентных соединений в воде зависит от их способности образовывать водородные связи с молекулами воды. Водородные связи-это диполь-дипольные взаимодействия между атомами водорода в молекулах воды и электроотрицательными атомами молекул растворенного вещества. Простые ковалентные соединения, как, например, диоксид серы, аммиак и хлороводород, растворяются в воде. Кислород, азот и диоксид углерода плохо растворяются в воде. Многие органические соединения, содержащие атомы электроотрицательных элементов, как, например, кислорода или азота, растворимы в воде. В качестве примера укажем этанол С2Н5ОН, уксусную кислоту СН3СООН, сахар С12Н22О6 и диэтиламин (C2H5)2NH.
Диаграмма состояния воды:
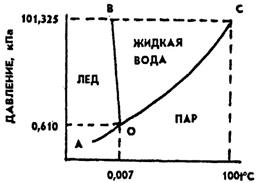
Зависимость растворимости:Гидрофильные обеспечивают растворимость в воде, гидрофобные — в неполярных растворителях. Соответствующим образом они располагаются на поверхности раздела фаз. Их основные физико-химические, а отсюда и технологические свойства зависят от химического строения и соотношения молекулярных масс гидрофильных и гидрофобных групп.
Хорошо растворимы - гидрофильные вещества
Гидрофобность - плохая растворимость, молекулы кластеризуются
Гидрофобные - соединения состоящие из электрически-нейтральных, неполярных химических групп - заряды атомов ~ 0 (малы)
Так как растворимость характеризует истинное равновесие, влияние внешних условийна это состояние (давления, температуры) можно качественно оценить, воспользовавшись принципом Ле Шателье.
Термодинамика растворения.
Растворение веществ часто происходит с выделением или поглощением теплоты, иногда с изменением объема.
Процесс растворения можно выразить схемой:
растворенное вещество + растворитель вещество в растворе ∆ Н .
Тепловой эффект, сопровождающий процесс растворения, относящийся к 1 молю растворенного вещества называется молярной теплотой растворения ∆ Н раств.
∆Н раств. = ∆Н 1 + ∆Н 2
∆Н 1> 0 - количество теплоты, затраченной на распределение частиц растворяемого вещества среди молекул растворителя (процесс эндотермический).
∆Н 2< 0 - тепловой эффект сольватации (процесс экзотермический).
Тепловой эффект сольватации - количество теплоты, которая выделяется при взаимодействии растворенного вещества с молекулами растворителя и образование связей между ними.
для твердого вещества:
∆Н1> 0 -энергия необходимая для разрушения кристаллической решетки и энергия необходимая для разрыва связей между молекулами растворителя (процесс эндотермический).
В зависимоссти от того преобладает первая или вторая составляющие, процесс растворения может быть экзотермический или эндотермический:
если │ ∆Н2 │> │∆ Н1│, процесс экзотермический и ∆Н < 0;
если │∆Н2 │< │∆ Н1│, процесс эндотермический и ∆Н > 0.
Растворы, образованные частицами строго одинакового размера, между которыми действуют примерно одинаковые силы межмолекулярного взаимодействия, не происходит химического взаимодействия, изменения температуры и объема называются идеальными. К идеальным растворам стремятся очень разбавленные растворы.
11.Растворение газов в жидкостях почти всегда сопровождается выделением теплоты. Поэтому растворимость газов с повышением температуры согласно принципу Ле Шателье понижается. Эту закономерность часто используют для удаления растворенных га–зов из воды (например С02 ) кипячением. Иногда рас–творение газа сопровождается поглощением теплоты (например, растворение благородных газов в некоторых органических растворителях). В этом случае повы–шение температуры увеличивает растворимость газа.
Газ не растворяется в жидкости беспредельно. При не–которой концентрации газа X устанавливается равновесие:

При растворении газа в жидкости происходит значительное уменьшение объема системы. Поэтому повышение давления согласно принципу Ле Шателье должно приводить к смещению равновесия вправо, т. е. к увеличению растворимости газа. Если газ малорастворим в данной жидкости и давление невелико, то растворимость газа пропорциональна его давлению. Эта зависимость выражается законом Генри (1803г.):количество газа, растворенного при данной температуре в определенном объеме жидкости, при равновесии прямо пропорционально давлению газа.
Закон Генри может быть записан в следующей форме:
с (Х) = Kr(X) * P(X)
где – концентрация газа в насыщенном растворе, моль/л;
P(X) – давление газа X над раствором, Па;
Kr(X) – постоянная Генри для газа X, моль/л-1 ? Па-1 .
Константа Генри зависит от природы газа, растворителя и температуры.
Закон Генри справедлив лишь для сравнительно разбавленных растворов, при невысоких давлениях и отсутствии химического взаимодействия между молекулами растворяемого газа и растворителем.
Закон Генри является частным случаем общего закона Дальтона. Если речь идет о растворении не одного газообразного вещества, а смеси газов, то растворимость каждого компонента подчиняется закону Дальтона: растворимость каждого из компонентов газовой смеси при постоянной температуре пропорциональна парциальному давлению компонента над жидкостью и не зависит от общего давления смеси и индивидуальности других компонентов.
Значение: изменение растворимости газов в крови при изменении давления могут вызывать тяжелые заболевания.
Кесонная болезнь — болезнь, которой страдают обычно водолазы. Пузырьки газов закупоривают сосуды в различных органах и тканях(эмболия), что может привести к тяжелому поражению тканей и даже гибели человека.
В последнее время при лечении газовой гангрены и ряда других заболеваний, применяют гиперборическая оксигенация, т. е. Помещают больных в барокамеры с повышенным давлением кислорода в воздухе. При этом улучшается снабжение тканей кислородом.
12.Разбавленные растворы неэлектролитов обладают рядом свойств (коллигативные свойства), количественное выражение которых зависит только концентрации. Некоторые коллигативные свойства растворов используются для определения молекулярной массы растворенного вещества.
Закон Рауля:
1. Понижение давления пара растворителя над раствором, ∆р
∆P/P = x2
Здесь ∆P/P – относительное понижение давления насыщенного пара растворителя над раствором, х2 — мольная доля растворенного вещества
2. Понижение температуры кристаллизации раствора, ∆tкрист
∆tкрист =K Сm
Здесь К - криоскопическая постоянная растворителя; m - моляльная концен-трация растворенного вещества.
3. Повышение температуры кипения раствора, ∆tкип
∆tкип =Е Cm.
Здесь Е -эбуллиоскопическая постоянная растворителя.
Эбулиометрия — совокупность методов определения молекулярной массы неэлектролитов, степени диссоциации слабых электролитов и осмотического давления, основанных на измерении разности температур кипения чистого растворителя и растворов исследуемых веществ
Криометрия — совокупность методов определения молекулярной массы неэлектролитов, степени диссоциации слабых электролитов и осмотического давления, основанных на измерении разности температур замерзания чистого растворителя и растворов исследуемых веществ
13. О́смос (от греч. ὄσμος — толчок, давление) — процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону бо́льшей концентрации растворённого вещества (меньшей концентрации растворителя).
Осмотическое давление — избыточное гидростатическое давление на раствор, отделённый от чистогорастворителя полупроницаемой мембраной, при котором прекращается диффузия растворителя через мембрану (осмос). Это давление стремится уравнять концентрации обоих растворов вследствие встречной диффузии молекул растворённого вещества и растворителя.
Вант-Гоффа закон определяет давление молекул растворённого вещества на полупроницаемую перепонку, отделяющую раствор от чистого растворителя и непроницаемую для растворённого вещества.
π=с(Х)RT
Растворы, имеющие одинаковое осмотическое давление, называют изотоническими. Изотоничкские растворы имеют одинаковое количество осмотически активных веществ.
Гипертонические растворы
Гипертонический раствор — раствор, имеющий бо́льшую концентрацию вещества по отношению к внутриклеточной.
Гипотонические растворы
Гипотонический раствор — раствор, имеющий меньшее осмотическое давление по отношению к другому, то есть обладающий меньшей концентрацией вещества, не проникающего через мембрану.
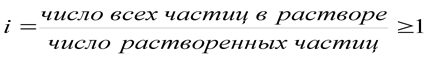 Для описания коллигативных свойств растворов электролитов используют изотонический коэффициент:
Для описания коллигативных свойств растворов электролитов используют изотонический коэффициент:
. (1.5)
Изотонический коэффициент показывает, во сколько раз суммарная эффективная концентрация недиссоциированных молекул и ионов в растворе больше по сравнению с начальной концентрацией недиссоциированных молекул. С ростом концентрации коэффициент I уменьшается.
Изоосмия, изотония - относительное постоянство осмотического давления в жидких средах и тканях организма, обусловленное поддержанием на данном уровне концентраций содержащихся в них веществ: электролитов, белков и т. д.
ГЕМОЛИЗ - разрушение эритроцитов, сопровождающееся выходом из них гемоглобина. Физические причины относится действие высоких и низких температур, ультразвука, к химическим - гемолитические яды, нек-рые лекарственные средства и др. Гемолиз может возникнуть при переливании несовместимой крови, введении гипотонических р-ров.
Плазмолиз-при помещении клеток в гипертонический раствор вода из клеток уходит в более концентрированный раствор и наблюдается сморщивание клеток.
Осмос имеет большое значение в жизнедеятельности человека, животных и растительных организмов. Как известно, все биологические ткани состоят из клеток, внутри которых находится жидкость (цитоплазма), представляющая собой раствор различных веществ в Н2О. Оболочка клетки полупроницаема и через нее достаточно свободно проходит вода.
Ионы электролитов и молекулы других веществ оболочка пропускает строго избирательно.
Снаружи клетки омываются межклеточной жидкостью, тоже представляющей собой водный раствор. Причем концентрация растворенных веществ внутри клеток больше чем в межклеточной жидкости. Вследствие осмоса наблюдается переход растворителя из внешней среды в клетку, что вызывает ее частичное набухание или тургор. При этом клетка приобретает соответствующую упругость и эластичность. Тургор способствует сохранению определенной формы органов у животных организмов, стеблей и листьев у растений. В срезанных растениях в результате испарения воды объем меж- и внутриклеточной жидкости уменьшается, снижается осмотическое давление, упругость клеток понижается и растение вянет. Увлажнение растений, помещение их в воду вызывает осмос и снова сообщает тканям упругость.
Кровь, лимфа, тканевые жидкости человека представляют собой водные растворы молекул и ионов многих веществ и обладают вследствие этого определенным осмотическим давлением. Причем на протяжении всей жизни организма биологические жидкости сохраняют свое давление на постоянном уровне независимо от состояния внешней среды. Это явление называется иначе изоосмией человеческого организма и является составной частью более общего процесса - гомеостаза или постоянства ряда физико-химических
14.Коллигативными называются свойства растворов, которые не зависят от природы растворенного вещества, а только от его концентрации. Такие свойства проявляются в полной мере в идеальных растворах.
Для бесконечно разбавленных растворов, состояние которых близко к состоянию идеальных, такими свойствами являются:
– осмотическое давление;
– понижение давления насыщенного пара над раствором;
– повышение температуры кипения;
– понижение температуры замерзания раствора
Реальные растворы электролитов по своим свойствам отличаются от идеальных.
Так, для растворов электролитов экспериментально найденные значения вышеперечисленных величин всегда больше, чем рассчитанные по законам Вант-Гоффа и Рауля. Т.е., растворы электролитов на практике ведут себя так, как будто они содержат больше частиц растворенного вещества, чем это следует из их аналитической концентрации. Исходя из этого, Вант-Гофф предложил для растворов электролитов при теоретическом расчете росм., ∆tкип., ∆tзам.,  использовать поправочный коэффициент i, который получил название коэффициента Вант-Гоффа или изотонического коэффициента:
использовать поправочный коэффициент i, который получил название коэффициента Вант-Гоффа или изотонического коэффициента:
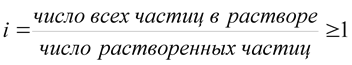 Для описания коллигативных свойств растворов электролитов используют изотонический коэффициент:
Для описания коллигативных свойств растворов электролитов используют изотонический коэффициент:
Изотонический коэффициент показывает, во сколько раз суммарная эффективная концентрация недиссоциированных молекул и ионов в растворе больше по сравнению с начальной концентрацией недиссоциированных молекул. С ростом концентрации коэффициент I уменьшается.
15.Сильные электролиты при растворении в воде практически полностью диссоциируют на ионы независимо от их концентрации в растворе.
Поэтому в уравнениях диссоциации сильных электролитов ставят знак равенства (=).
К сильным электролитам относятся:
- растворимые соли;
- многие неорганические кислоты: HNO3, H2SO4, HCl, HBr, HI;
- основания, образованные щелочными металлами (LiOH, NaOH, KOH и т.д.) и щелочно-земельными металлами (Ca(OH)2, Sr(OH)2, Ba(OH)2).
Слабые электролиты в водных растворах лишь частично (обратимо) диссоциируют на ионы.
Поэтому в уравнениях диссоциации слабых электролитов ставят знак обратимости (⇄).
К слабым электролитам относятся:
- почти все органические кислоты и вода;
- некоторые неорганические кислоты: H2S, H3PO4, H2CO3, HNO2, H2SiO3 и др.;
- нерастворимые гидроксиды металлов: Mg(OH)2, Fe(OH)2, Zn(OH)2 и др.
Степень диссоциации (α) – это отношение числа продиссоциировавших (распавшихся) на ионы молекул (n) к общему числу растворенных молекул (N):
n
α = —
N
Ионизация слабых электролитов сопровождается обычно общим уменьшением объема благодаря кулоновскому взаимодействию молекул растворителя на большом расстоянии. Это выражается в сильном увеличении константы ионизации с ростом давления.
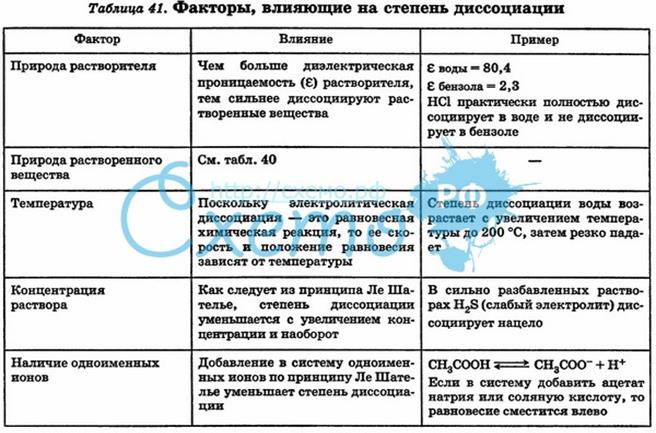
Степень ионизации слабого электролита сильно зависит от одновременного присутствия в растворе сильного электролита, имеющего с ни м общие ионы.
Ка — константа кислотности (чем больше Ка — тем сильнее электролит)
Кb — константа основности
pKa=-lgKa
pKb=-lgKb
 Константа диссоциации зависит только от природы растворителя, электролита, температры, но не зависит от концентрации.
Константа диссоциации зависит только от природы растворителя, электролита, температры, но не зависит от концентрации.
Закон разведения Оствальда: степень диссоциации слабого электролита возрастает с разбавлением раствора.
Билет 16. Основные положения теории растворов сильных электролитов Дебая – Хюккеля. Активность, коэффициент активности ионов. Ионная сила раствора. Кажущаяся степень диссоциации. Электролиты в организме.
Основные положения теории Дебая – Хюккеля:
1. Ионы – материальные точки с зарядами, т.е. размеры их значительно меньше расстояний между ними (в разбавленных растворах)
2. Взаимодействие между ионами носит чисто кулоновский характер(ион – дипольное взаимодействие с молекулами растворителя и образование ассоциатов не учитывается)
3. Диэлектрическая проницаемость раствора равна диэлектрической проницаемости растворителя
4. Распределение ионов вокруг центрального иона подчиняется законам статистической термодинамики - распределение Больцмана (определяет распределение частиц в силовом поле в условиях теплового равновесия)
При движении ионов под действием электрического поля ион данного знака движется к противоположно заряженному электроду, а окружение его - «ионная атмосфера» тормозит движение и уменьшает подвижность иона.
В результате тормозящего действия «ионных атмосфер» (межионного взаимодействия) снимается эффективность ионов в таких явлениях как перенос заряда (электрический ток) в растворах, уменьшается температура замерзания, увеличивается температура кипения. Именно поэтому определяемая, например, по электрической проводимости растворов степень диссоциации является кажущейся степенью диссоциации,т.к. онане соответствует действительной степени распада электролита на ионы.
Активность. Под активностью электролита понимают эффективную концентрацию, в соответствии с которой он участвует в различных процессах.
a(X)= f(X) * c(X)
a(X) – активность электролита
f(X) – коэффициент активности(величина безразмерная)
c(X) – концентрация электролита
Коэффициент активности f(X) выражает отклонение раствора с концентрацией c(X) от поведения раствора при бесконечном разведении, т.е. в отсутствии межионных взаимодействий.
Если f(X) = 1, движение ионов не стеснено действием электрических сил и в этом случае ионы можно рассчитывать по формуле a(X)= f(X) * c(X)
Если f(X) < 1, на движение ионов оказывает влияние их электростат.взаимодействие и во все уравнения для закона действующих масс и вычисления коллигативных свойств раствора вместо концентрации с надо подставлять меньшую по значению активность а.
Ионной силой раствораназывают величину, измеряемую полусуммой произведений концентрации всех находящихся в растворе ионов на квадрат их заряда.
I=0,5[b(x1)z12 + b(x2)z22 +….+b(xn)zn2 ]
I – ионная сила
b(x1), b(x2), b(x..) – моляльные концентрации ионов х1, х2, х..
z1, z2, z.. – заряды ионов х1, х2, х..
Содержанием слабых и сильных электролитов определяет кислотнощелочное равновесие в крови и биожидкостях: Na2HPO4, NaH2PO4, H2CO3, NaHCO3. Концентрация ионов регулирует распределение вод между внеклеточным пространством и мочой.
Ионы играют определенную роль в создании осмотического давления различных биологических жидкостей. Особенности метаболического обмена ионов имеют большое значение для жизнедеятельности организма.
Пример: Обмен ионов К+ важен для работы нервных и мышечных клеток. При нарушении работы почек происходит уменьшение концентрации ионов К внутри клеток, что приводит к заболеванию - периодическому параличу. При восстановлении концентрации ионов паралич проходит.
Дата добавления: 2016-02-02; просмотров: 2990;
