Природа химической связи в комплексных соединениях
Во внутренней сфере между комплексообразователем и лигандами существуют ковалентные связи, образованные в том числе и по донорно-акцепторному механизму. Для образования таких связей необходимо наличие свободных орбиталей у одних частиц (имеются у комплексообразователя) и неподеленных электронных пар у других частиц (лиганды). Роль донора (поставщика электронов) играет лиганд, а акцептором, принимающим электроны, является комплексообразователь. Донорно-акцепторная связь возникает как результат перекрывания свободных валентных орбиталей комплексообразователя с заполненными орбиталями донора.
Между внешней и внутренней сферой существует ионная связь.
Билет 30.
Изомерия и пространственное строение комплексных соединений. Пространственное строение комплексных соединений. Классы комплексных соединений: внутрикомплексные, анионные, катионные, нейтральные.
Одинаковые лиганды симметрично располагаются в пространстве вокруг центрального атома. Чаще встречаются четные координационные числа — 2, 4, 6. Им соответствуют следующие геометрические конфигурации:
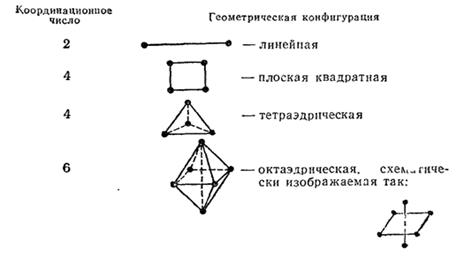
Впервые правильные представления о пространственном строении комплексных соединений были сформулированы А. Вернером. При этом он исходил из найденного опытным путем числа изомеров при наличии двух или более различных лигандов в комплексе и сравнивал его с возможным числом для той или иной предполагаемой конфигурации. Так, для координационного числа 4 и тетраэдрической конфигурации все положения лигандов относительно центрального атома эквивалентны.
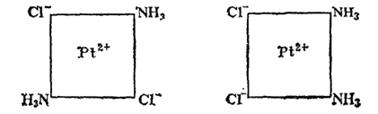
Рис. 158. Пространственное строение изомеров : слева — транси-зомер; спара - цис-изомер.
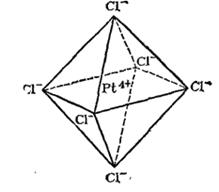
Рис. 157. Пространственное строение комплексного иона .
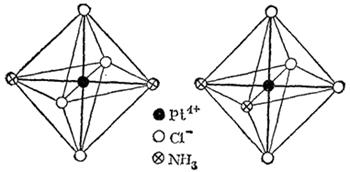
Рис. 158. Пространственное строение изомеров : слева — транс-изомер; справа — цис-изомер.
Поэтому тетраэдрические комплексы типа (где М — центральный атом, а А и В — лиганды) не имеют изомеров. Другое наблюдается в комплексах платины (II); например, встречается в двух изомерных формах, отличающихся по цвету, растворимости, дипольному моменту, реакционной способности и способам получения. Отсюда был сделан вывод о расположении лигандов по квадрату вокруг центрального атома, так как именно для этой конфигурации у соединений типа должно иметься два изомера. В одиом из изомеров комплекса атомы хлора разделены центральным атомом (транс-изомер), а в другом (цис-изомер) они находятся рядом друг с другом, по одну сторону от центрального атома (рис. 156).
При увеличении числа различных заместителей число изомеров растет и для соединений типа [MABCD] для квадратной конфигурации возможно уже три изомера.
Изучая явлеиия изомерии комплексных соединений с координационным числом 6, Вернер пришел к выводу, что в этом случае лиганды должны быть симметрично расположены вокруг центрального иона, образуя фигуру правильного октаэдра (рис. 157). Если все координированные группы одинаковы, как показано на рисунке, то, конечно, перестановка одной группы на место другой не изменит структуры комплекса. Но если группы не одинаковы, то возможно различное их расположение, вследствие чего могут образоваться изомеры. И действительно, опыт показывает, что, например, соединение (где координационное число платины равно 6) существует в двух изомерных формах, отличающихся одна от другой по своей окраске и другим свойствам. Строение этих изомеров, по 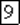 показано на рис. 158. В одном случае молекулы
показано на рис. 158. В одном случае молекулы  помещаются у противоположных вершин октаэдра (транс-изомер), в другом — у соседних (цис-изомер).
помещаются у противоположных вершин октаэдра (транс-изомер), в другом — у соседних (цис-изомер).
Рис. 159. Кристаллическая решетка  .
.
Подобного рода пространственная изомерия наблюдается и у ряда других комплексов с шестью лигандами во внутренней сфере.
Предположения Вернера относительно октаэдрического строения комплекса с координационным числом 6 блестяще подтвердились при рентгенографическом исследовании кристаллов соответствующих соединений. На рис. 159 изображена кристаллическая решетка комплексной соли  . В ней комплексные ионы
. В ней комплексные ионы  находятся в вершинах и центрах граней куба, причем хлорид-ионы в комплексе расположены в вершинах правильного октаэдра. Таким образом,
находятся в вершинах и центрах граней куба, причем хлорид-ионы в комплексе расположены в вершинах правильного октаэдра. Таким образом,  не только сохраняется в растворах, но и является самостоятельной структурной единицей в кристаллической решетке.
не только сохраняется в растворах, но и является самостоятельной структурной единицей в кристаллической решетке.
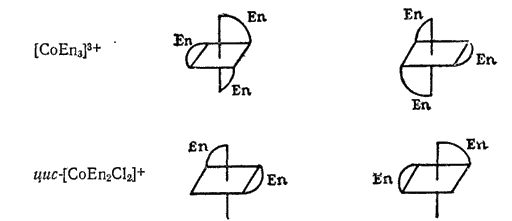
К геометрической изомерии можно отнести и зеркальную (опти-ческую) изомерию, рассмотренную ранее (стр. 446) на примерах органических соединений. Например, комплексы  — этилендиамин) и
— этилендиамин) и  существуют в виде двух зеркальных антиподов:
существуют в виде двух зеркальных антиподов:
Классы комплексных соединений:
Внутрикомплексные соединения (ВКС) - координационные соединения металлов с одинаковыми или различными бидентатными (обычно - органическими) ацидолигандами, связанными с одним и тем же атомом металла-комплексообразователя через одну отрицательно заряженную и одну нейтральную донорные группы с образованием одинаковых или различных внутренних металлоциклов (хелатных циклов), не содержащие внешнесферных ионов и являющиеся комплексами-неэлектролитами. Примером ВКС может служить глицинат меди(II) и оксихинолинат цинка,а также такие практически важные соединения, как комплексы металлов с оксиоксимами, нитрозогидроксиламинами, нитрозофенолами, различными аминокислотами и т.д.
катионные - комплексный катион в комплексном соединении [Co(NH3)6]Cl3
анионные- комплексный анион в комплексном соединении K[PF6]
нейтральные– комплесное соединение, где заряд комплекса равен 0.
Дата добавления: 2016-02-02; просмотров: 2685;
