Кислородсодержащие соединения галогенов
Галогены непосредственно с кислородом не взаимодействуют. Это обусловлено небольшой энергией связи Г-О и невозможностью использовать высокие температуры для осуществления реакций окисления, т.к. для них ∆S0 <0, оксиды получают косвенным путём.
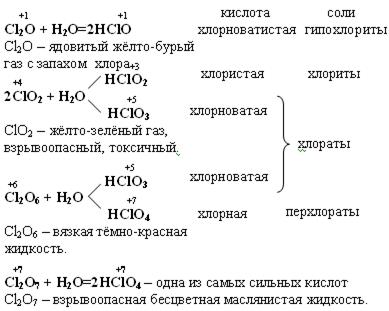
При 25ºС сравнительно стабильны следующие кислородные соединения:
+1 +4 +6 +7
Cl2O ClO2 Cl2O6 Cl2O7
в соединениях с О2 хлор проявляет степени окисления (с. о.):
с. о. +1 +3 +4 +5 +6 +7
оксид Cl2O ClO2
Cl2O4 Cl2O6 Cl2O7
кислота HClO HClO2 HClO2 HClO3 HClO3 HClO4
HClO3 HClO4
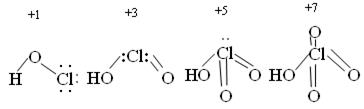
Если сопоставить свойства кислот со структурой молекул, то можно отметить следующее: с ростом степени окисления хлора уменьшается число несвязывающих электронных пар и происходит постепенное достраивание кислородного окружения хлора до тетраэдрического.
Увеличение силы кислот HClO – HСlO4 обусловлено тем, что с ростом числа кислородных атомов электронные облака всё больше стянуты к центральному атому и связь Н – О становится всё более полярной.
Окислительные свойства уменьшаются, у оксо-анионов
ClO-, ClO2-, ClO3-, ClO4- - увеличивается прочность связи кислорода с хлором.
Оксикислоты хлора

Возрастание силы кислот связано с увеличением количества кислорода, который оттягивает на себя электронную плотность и прочность связи Н – О ослабевает.
Возрастание устойчивости связано с увеличением степени окисления хлора и большим количеством электронов, принимающих участие в образовании связи. Во всех соединениях Cl – в sp3 гибридизации.
Самая высокая окислительная способность у хлорноватистой кислоты, за счет атомарного кислорода.
HСlO = HCl + O
Реакции разложения HClO
1. HClO → HСl + O
2. 2HCl+1O → HCl- + HCl+3O2
3. 2HClO → Cl2O + H2O
Cl2 + H2O → HCl + HClO
ClF + H2O → HClO + HF
Cl2 +KOHхол → KCl + KClO + H2O
Cl2 + KOHгор → KCl + KClO3 + H2O
Гипохлорит калия KClO → KCl + O2
KClO → KCl + KClO2
(KClO3)
(KClO4)
Получение белильной извести.
Cl2 + Ca(OH)2 → CaOCl2 + H2O
-  очень сильный окислитель даже на воздухе разлагается
очень сильный окислитель даже на воздухе разлагается
CaOCl2 + СО2 + H2O → CaCl2 + CaCO3 + O
CaOCl2 + HCl → CaCl2 + Cl2 + H2O
ClO2 – газ жёлтого цвета HClO3 напоминает HNO3
KClO3 - бертолетова соль
Cl2O6 - тёмно-красная жидкость, получена
2ClO2 + O3 → Cl2O6 + O2
Cl2O7 - маслянистая бесцветная жидкость, получается
обезвоживанием HСlO4
2HСlO4 + P2O5 → Cl2O7 + 2HPO3
Окислительные свойства почти не проявляет
KClO4 + H2SO4 (к) → HClO4 + KHSO4
KClO4 → KCl + O2разложение
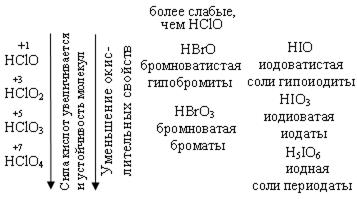
Самая высокая окислительная способность у хлорноватистой кислоты.
HСlO = HCl + O
Дата добавления: 2016-01-30; просмотров: 2053;
