Как наиболее электроотрицательного элемента
Фтор. Из всех галогенов у него наименьший радиус. Относительная электроотрицательность равна 4, это самый электроотрицательный элемент, во всех соединениях имеет степень окисления – 1, остальные галогены от – 1 до + 7.
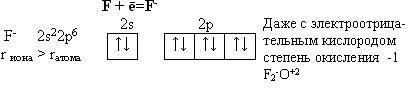
Строение молекулы F2 по МВС
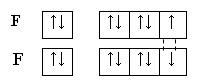
(обменный механизм)
Строение молекулы F2 по ММО
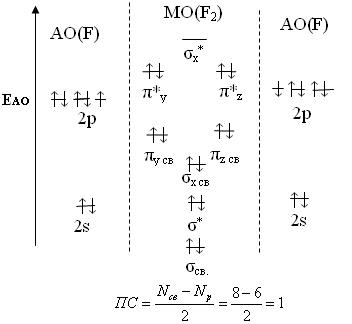
Исключительная химическая активность фтора обусловлена с одной стороны большой прочностью образуемых им связей, так энергия связи H - F 566кДж/моль, с другой стороны низкой энергией связи в молекуле F2 – 151кДж/моль.
Большая энергия связей Э – F является следствием значительной электроотрицательности фтора и малого размера его атома.
Низкое значение энергии связи в молекуле F2, объясняется сильным отталкиванием электронных пар, находящихся на π- орбиталях, обусловленным малой длинной связи F – F. Благодаря малой энергии связи молекулы фтора легко диссоциируют на атомы и энергия активации реакций с элементарным фтором обычно невелика, поэтому процессы с участием F2 протекают очень быстро.
Дата добавления: 2016-01-30; просмотров: 1666;
