Химические свойства галогенов. Стандартная энтальпия диссоциации ∆Н > 0 (энергия поглощается)
Стандартная энтальпия диссоциации ∆Н > 0 (энергия поглощается)
Э2(г) = 2Э(г)
Первое сродство к электрону галогена X(г) + ē = X-(г) ∆Н<0 (энергия выделяется).
Энергия выделяется при образовании галогенида
M+(г) + X-(г) →MX(тв)
Фтор реагирует со взрывом со всеми металлами и неметаллами, кроме O2, N2, Гal2 при этом во всех соединениях с фтором элементы имеет высшую степень окисления.
Например:
SiO2 + 2F2 = Si+4F4 + O2 (во фторе горит SiO2, H2O)
t = 0º – 90º Н2O + F2 = Н+F + O+2F2 (H2O + F2=HF + O2 (O3)
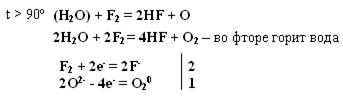
2 Au + 3F2 = 2AuF3
5P + 5F2 = 2PF5
2NH3 + 3F2 = 6HF + N2
F2 + NaOHP → NaF + OF2 + H2O
2F2 + 4NaOHК → 4NaF + O2 + 2H2O
(O3)
F2 + Xe → XeF4
В ряду Cl2, Br2, I2 окислительная активность падает, а восстановительная активность увеличивается, поэтому, если протекает реакция,
Cl2 + I2 + H2O→HCl + HIO3
ок. восст
хлор выступает в роли окислителя.
1) Галогены реагируют с неметаллами, образовывая галогениды:
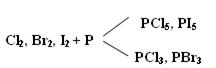
2) С металлами, которые приобретают высшую степень окисления:
2Fe + 3Cl2 → 2FeCl3
3) реагируют с H2, только Br2 и Cl2

4)Cl2 и Br2 реагируют с H2Oобразуя хлорную и бромную воду, а с I2 реакция практически не протекает
Гal2 + H2O→HГal + HГalO
5) Гal взаимодействует с растворами щёлочей, продукты зависят от температуры
Cl2 +NaOH → NaCl + NaClO + H2O
t >70ºC
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 2H2O
с I2 один продукт, NaIO3, а NaIO – не образуется.
I2 + NaOH → NaI + NaIO3 + H2O
В ряду Cl2 – Br2 – I2 – металлические свойства усиливаются, что связано с увеличением размера атома. Поэтому I2 реагируя с концентрированной HNO3, образует катион I+, или присутствует в кислотном остатке в виде IO3-.
I2 + AgNO3 → AgI + INO3
I2 + HNO3 конц.→ HIO3 + NO2 + H2O
IСlO4 – перхлорат йода, йод в катионной форме неустойчив

Водные растворы HГаl – кислоты, сила кислот ↓ увеличивается.
- Способы получения галогеноводородов и их свойства
HFH2 + F2 – не получается из-за высокой Q
1)СaF2 + H2SO4 → CaSO4↓ + 2HF↑
t летуча
2)KHF2 → KF + HF
hν
HCl 1) H2 + Cl2 → 2HCl
2) NaClк + H2SO4 конц. → NaHSO4 + HCl↑
3) BCl3 + H2O → H3BO3 + HCl↑
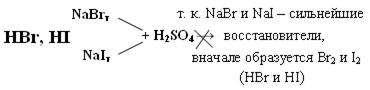
Протекает ОВР
NaBr + H2SO4 → Br2 + SO2 + Na2SO4 + H2O
NaI + H2SO4 → I2 + S + Na2SO4 + H2O
(H2S)
Поэтому HBr и HI получают гидролизом галогенидов фосфора.
PBr5 + 4H2O → H3PO4 + 5HBr-
PBr3 + H2O → HBr↑+ H3PO3-
PI3 + 3H2O → H3PO3 + 3HI
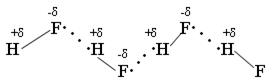
Безводный HF неэлектролит, а в жидком HF возможны процессы ионизации.
2HF → H+ + HF2-
3HF → HF2- + H2F+
Жидкий HF образует целые цепочки, состоящие из молекул HF- (6,8) (HF)4, (HF)6, (HF)8, только при t = 3500ºС возможен разрыв связи H – F.
Вследствие наличия сильной водородной связи даже в парах молекулы HF ассоциированы. HF может смешиваться с Н2О в неограниченном количестве, образуя слабую плавиковую кислоту, при этом между молекулами HF и Н2О также возникают водородные связи.
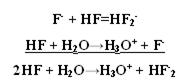
HF хранят в сосудах из платины или полиэтилена. В стеклянном сосуде хранить нельзя т. к. в стекле есть SiO2, а плавиковая кислота разрушает стекло.
SiO2 + 4HF = SiF4 + 2H2O – реакция травления стекла
SiF4 + 2HF = H2[SiF6]
Для HF характерны обычные свойства кислот
Zn + 2HF = ZnF2 +H2
3HF + Al(OH)3 = AlF3 +3H2O
HF + KOH = KHF2 + H2O
NH3 +2HF = NH4HF2
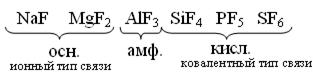
Фториды – в основном нерастворимые соединения. Как и другие бинарные соединения они бывают:
Основные - галогениды металлов.
Амфотерные - с амфотерными элементами.
Кислотные - с неметаллами.
2KF +SiF4 → K2[SiF6]
3NaF + AlF3 → Na3[AlF6] 2KF + BeF2→ K2[BeF4]
O K O K
3SiF4 + 2AlF3 → Al2[SiF6]3
K O
2KI + HgI 2→ K2[HgI4] KBr + AlBr3 → K[AlBr4]
К О
Для элементов 2-го периода К.ч. = 4
3-го периода К.ч. = 6
Основные фториды гидролизуются, только растворимые в воде:
2NaF + H2O → NaHF2 + NaOH
Кислотные гидролизуются с образованием 2-х кислот:
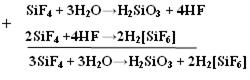
Дата добавления: 2016-01-30; просмотров: 1833;
