Твердофазный синтез
Комбинаторный синтез можно проводить не только в растворе (жидкофазный синтез), но и на поверхности твёрдой химически инертной фазы. В этом случае первое исходное вещество химически „пришивают“ к функциональным группам на поверхности полимерного носителя (чаще всего используют сложноэфирную или амидную связь) и обрабатывают раствором второго исходного вещества, которое берётся в значительном избытке, чтобы реакция прошла до конца. В такой форме реакции есть определённое удобство, поскольку облегчается техника выделения продуктов: полимер (обычно в виде гранул) просто отфильтровывают, тщательно промывают от остатков второго реагента и химически отщепляют от него целевое соединение.
В органической химии нет ни одной реакции, обеспечивающей на практике количественные выходы целевых продуктов в любом случае. Единственное исключение составляет, по-видимому, полное сжигание органических веществ в кислороде при высокой температуре до СО2 и Н2О. Поэтому очистка целевого продукта всегда является непременной, а часто самой сложной и трудоемкой задачей. Особенно сложной задачей является выделение продуктов пептидного синтеза, например, разделение сложной смеси полипептидов. Поэтому именно в пептидном синтезе наибольшее распространение получил метод синтеза на твердой полимерной подложке, разработанный в начале 60-х годов ХХ века Р.Б.Мерифилдом.
Полимерный носитель в методе Меррифилда – это гранулированный сшитый полистирол, содержащий хлорметильные группы в бензольных ядрах, которые являются линкерами, связывающими подложку с первым аминокислотным остатком полипептида. Эти группы превращают полимер в функциональный аналог бензилхлорида и сообщают ему способность легко образовывать сложноэфирные связи при реакции с карбоксилат-анионами. Конденсация такой смолы с N-защищенными аминокислотами ведет к образованию соответствующих бензиловых эфиров. Удаление N-защиты из дает С-защищенное производное первой аминокислоты, ковалентно связанное с полимером. Аминоацилирование освобожденной аминогруппы N-защищенным производным второй аминокислоты с последующим удалением N-защиты приводит к аналогичному производному дипептида также привязанному к полимеру:

Такой двухстадийный цикл (удаление защиты - аминоацилирование) может быть, в принципе, повторен столько раз, сколько требуется для наращивания полипептидной цепи заданной длины.
Дальнейшее развитие идей Мерифильда было направлено, прежде всего, на поиск и создание новых полимерных материалов для подложек, разработку методов разделения продуктов и создания автоматизированных установок для всего цикла полипептидного синтеза
Эффективность метода Мерифилда была продемонстрирована успешным синтезом целого ряда природных полипептидов, в частности инсулина. Особенно наглядно его преимущества были продемонстрированы на примере синтеза фермента рибонуклеазы. Так, например, ценой значительных усилий, в течение нескольких лет, Хиршмен с 22 сотрудниками выполнили синтез фермента рибонуклеазы (124 аминокислотных остатка) с помощью традиционных жидкофазных методов. Почти одновременно тот же белок был получен путем автоматизированного твердофазного синтеза. Во втором случае синтез, включающий всего 11 931 различных операций, в том числе и 369 химических реакций, был выполнен двумя участниками (Гатте и Меррифильдом) всего за несколько месяцев.
Идеи Меррифильда послужили основой для создания различных методов комбинаторного синтеза библиотек полипептидов различного строения.
Так в 1982 году была предложена оригинальная стратегия многостадийного параллельного синтеза пептидов на твёрдой фазе известная как „сплит-метод“ (split — расщепление, разделение) или метод “смешай и раздели” (рис. 3). Суть ее состоит в следующем. Допустим, что из трёх аминокислот (А, В и С) нужно получить все возможные комбинации трипептидов. Для этого гранулы твёрдого полимерного носителя (Р) разделяют на три равные порции и обрабатывают их раствором одной из аминокислот. При этом все аминокислоты химически связываются с поверхностью полимера одной из своих функциональных групп. Полученные полимеры трёх сортов тщательно смешивают, и смесь опять разделяют на три части. Затем каждую часть, содержащую все три аминокислоты в одинаковых количествах, вновь обрабатывают одной из тех же трёх аминокислот и получают девять дипептидов (три смеси по три продукта). Ещё одно смешение, разделение на три равные части и обработка аминокислотами дают искомые 27 трипептидов (три смеси по девять продуктов) всего через девять стадий, тогда как получение их по отдельности потребовало бы синтеза из 27×3 = 81 стадий.
 Рис. 3. Сплит-метод синтеза комбинаторной библиотеки
Рис. 3. Сплит-метод синтеза комбинаторной библиотеки
|
Планирование и дизайн комбинаторного синтеза
Для успешного нахождения новых соединений - лидеров методом комбинаторного синтеза необходимо генерировать библиотеки, содержащие большое число различных химических структур, при минимальном числе операций и из минимального количества исходных билдинг - блоков.
Многие комбинаторные библиотеки создают путём последовательной дериватизации (derivative - соединение, полученное из предшественника) исходного билдинг-блока, который еще называется „темплейт“ (templatе- образец, шаблон) (рис.4). Такой темплейт имеет определенную постоянную базовую структуру и несколько функциональных групп, которые на разных этапах синтеза последовательно реагируют с другими билдинг-блоками. Темплейт и интермедиаты (промежуточные продукты) первого уровня (рис.4) обычно нарабатывают в больших количествах (соответственно сотни и десятки граммов) обычным классическим синтезом, а затем проводят параллельный синтез.
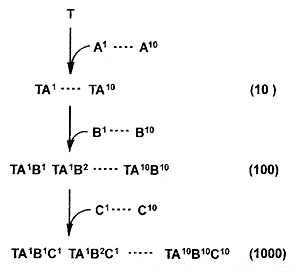
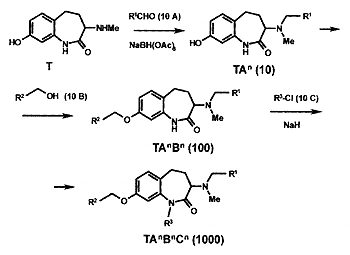 Рис. 4. Многостадийный комбинаторный синтез (дериватизация темплейта). Т — темплейт, А, В, С — билдинг-блоки последовательных стадий, ТА —
интермедиаты первого уровня, TAB — интермедиаты второго уровня, ТАВС — комбинаторная библиотека
Рис. 4. Многостадийный комбинаторный синтез (дериватизация темплейта). Т — темплейт, А, В, С — билдинг-блоки последовательных стадий, ТА —
интермедиаты первого уровня, TAB — интермедиаты второго уровня, ТАВС — комбинаторная библиотека
|
Темплейты
В общем случае, наилучшим вариантом темплейта являются “паукообразные” молекулы, называемые так, потому что они по аналогии с пауком, содержат базовый центральный фрагмент (называемый центроидом или подпоркой (scaffold)), к которому присоединены различные “щупальца” - заместители.
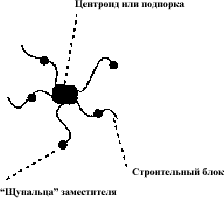
Эти “щупальца” содержат различные функциональные группы, которые могут быть использованы для нащупывания положений (расположения функциональных групп активного центра) мишени, с которыми эта паукообразная молекула может вступить во взаимодействие. Шанс успеха повышается, если “щупальца” равномерно распределены вокруг центроида и охватывают все трехмерное пространство вокруг молекулы.

Еще более успешным может быть использование молекул, которые имеют различные функциональные группы, находящиеся на различном расстоянии от центроида.
Дата добавления: 2016-01-30; просмотров: 2561;
