Сшивание с помощью линкера
Линкерные фрагменты не только обеспечивают объединение генов, но и обусловливают их экспрессию, в связи с чем часто в середину линкера помещают какой либо регуляторный генетический элемент, например промотор, или участок связывания с рибосомой.
После того как рекомбинантная ДНК сшита, ее можно ввести в живые клетки. Но поскольку она не способна к самовоспроизведению, ее быстро разрушат внутриклеточные нуклеазы. Для того чтобы рекомбинантная ДНК стала составной частью генетического аппарата клетки, она должна либо встроиться (интегрироваться) в ее геном (в хромосому) и реплицироваться за его счет, либо быть способной к автономной репликации. Принято молекулы ДНК, способные акцептировать чужеродную ДНК и автономно реплицироваться, называть векторными молекулами. К числу векторов относят плазмиды, бактериофаги, вирусы животных. Векторы должны обладать следующими особенностями:
1. Иметь субстратные участки для определенных эндонуклеаз рестрикции, в которые после их разрезания можно встроить нужный ген.
2. Иметь свойства репликона, т.е самовоспроизводиться.
3. Содержать один или несколько маркерных генов, которые после проникно-вения вектора в клетку придают ей фенотип, свидетельствующий о присутствии вектора.
В частности, для бактериальных векторов в качестве маркерных генов чаще всего используются гены, вызывающие устойчивость клеток к некоторым антибиотикам.
4. Иметь малый размер и способность проникать через клеточную оболочку
Таким образом, все векторы обеспечивают репликацию встроенных генов, их экспрессию, интеграцию в хромосому клетки и т.д.
Чаще других в генетической инженерии в качестве векторов используют плазмиды. Плазмидаминазывают специфические бактериальные репликоны (внехромосомные элементы наследственности), способные к длительному автономному существованию и стабильно наследуемые. Они представляют собой двуцепочечные кольцевые молекулы ДНК с вариабельными молекулярными массами. По размеру они соответствуют 1 - 3 % от хромосомы бактериальной клетки. Так, молекулярная масса одной из самых мелких плазмид, найденных у Е. coli,составляет 1,5 МДа, а клетки псевдомонад содержат плазмиды с Мг около 300 МДа, что составляет 15 % от Mв хромосом этих бактерий. Плазмиды разделяют на конъюгативные, способные сами перенестись в реципиентные клетки с помощью конъюгации, и неконъюгативные, не обладающие этим свойством. Они детерминируют разные свойства: резистентность кантибиотикам (R-плазмиды);биодеградацию(D-плазмиды)и др. Например, плазмиды стафилококков несут гены устойчивости к пенициллину, соединениям ртути и др. Гены устойчивости к тяжелым металлам обнаружены также в составе R-плазмид Е. coli. Плазмиды могут управлять синтезом инсектицида в клетках Bacillus thuringiensis. F-плазмида Е. coliили FP-плазмиды псевдомонад являются половыми факторами. Плазмида pSIOl с Мг 5,8 МДа несет ген устойчивости к тетрациклину (селективный маркер). У различных микроорганизмов - Е. coli, Salmonella, Bacillus, Saccharomycesобнаружены Col-плазмиды, обеспечивающие синтез разных колицинов - высокоспецифических антибиотиков, подавляющих жизнедеятельность других штаммов микроорганизмов того же вида или родственных видов. Количество плазмид в клетке может колебаться от одной до более ста. В целом, чем крупнее плазмида, тем меньше количество ее копий в клетке.
Первый плазмидный вектор был получен С.Коэном (1973). Его источником была плазмида Е. coli R6-5 с Mr 65 кДа. Плазмида стала родоначальником серии векторов и других структур.
Особое место в генетическом манипулировании занимает плазмида (ColE1), относящаяся к группе колициногенных плазмид Е.coli. ColE1 реплицируется независимо от хромосомы и присутствует в количестве примерно 24 копий на клетку. Ее широко используют благодаря селективному маркеру (способность к синтезу антибиотика колицина) в качестве вектора для клонирования фрагментов про- и эукариотической ДНК в Е. coli.
Плазмида pBR313 содержит уникальные участки расщеплений нескольких рестриктаз: EcoRI, Hindlll, BamHI, Sail, Xmal и Hpal. Конструируя рекомбинантную ДНК, в эти участки можно встраивать фрагменты чужеродной ДНК, полученные с помощью соответствующих рестриктаз.
На рис. изображена схема расположения генов в плазмиде pBR322.
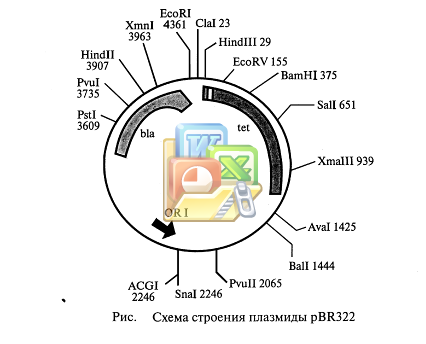
Плазмида pBR322 содержит два гена, программирующих устойчивость к двум различным антибиотикам - тетрациклину (ген tet) и ампициллину (ген blа). В гене tet находятся уникальные участки расщепления рестриктазами HindIII, BamHI и SalI, а в гене blа - участок расщепления PstI. Если разрезать плазмиду любой из рестриктаз, участок расщепления которой находится в гене tet, и соединить ее методом «липких» концов с чужеродным фрагментом ДНК, то в полученной рекомбинантной молекуле останется нетронутым только генblа, а ген tet утрачивает свою активность, так как его целостность нарушается вставкой. Напротив, при разрезании плазмиды рестриктазой PstI и внедрении в этот участок фрагмента ДНК инактивируется ген blа, тогда как ген tet продолжает кодировать белок, обеспечивающий устойчивость Е. coliк тетрациклину. Плазмидные векторы в настоящее время чрезвычайно разнообразны за счет следующих свойств:
1.Наличие большого количества участков рестрикции, отвечающих различным рестриктазам.
2.Возможность уменьшения размеров плазмиды вследствие изъятия участков, не обязательных для репликации и замены их клонируемыми генами.
3.Гибридизации векторов одного рода с другими векторами или природными плазмидами (например, получены гибридные векторыкомбинацией плазмиды и фага λ(при этом вновь сконструированная рекомбинантная ДНК должна сохранить репликационные свойства исходной плазмиды);
4.Наличие селективных генетических маркеров, позволяющих вести отбор рекомбинантных клонов.
Эукариотические вирусыдо сих пор нашли более скромное применение в качестве векторов. Практически используются только онкогенный вирус SV 40 и его производные. Все эти векторы - дефектные вирусы, не способные давать полноценные вирусные частицы в клетке хозяина. Клонируемую ДНК можно вводить и в другие репликоны, способные размножаться в клетках, например бактериофаги. Чаще всего из известных фагов в качестве векторов применяют сконструированные производные фага λи фагов М13 и fd. В векторах на основебактериофага λ используется его особенность, состоящая в том, что большая часть его ДНК не участвует в размножении фага в клетке и может быть удалена . Это позволяет вводить вместо нее чужеродную, клонируемую ДНК в ДНК фага λ и использовать его в качестве вектора.
Векторные плазмиды и векторные вирусы со встроенными чужеродными генами часто называютгибридными (или химерными) плазмидами (или фагами). После конструирования рекомбинантных ДНК их с помощью трансформации вводят в реципиентный организм: бактериальную, грибную, растительную или животную клетку. Трансформация предусматривает предвари-тельную обработку клеток соединениями, обусловливающими проникновение ДНК внутрь клеток (раствор СаС12) за счет увеличения проницаемости клеточной стенки, с последующим их помещением в селективирующую среду, в которой способны существовать только клетки, получившие векторную молекулу, например в среду с определенным антибиотиком. Другим способом увеличения проницаемости клеточной стенки является электропорация,когда клеточную суспензию обрабатывают короткими импульсами переменного тока высокого напряжения (порядка 2500 вольт). После такой обработки эффективность трансформации повышается, в зависимости от размеров плазмид, в 106 – 109 раз.
Процесс инфицирования клеток с помощью чужеродных ДНК, приводящий к образованию зрелого фагового потомства, назван трансфекцией.
Однако эффективность проникновения экзогенной ДНК в клетку довольно низка. Поэтому среди бактерий, подвергшихся трансформации, только небольшая часть оказывается трансформированной (обычно одна из тысячи). Кроме того, часть этих бактерий может содержать исходную, не трансформированную плазмиду. Отделение клеток, содержащих рекомбинантную ДНК, от общей массы осуществляется в процессе клонирования. Для клонирования трансформиро-ванную бактериальную суспензию низкой концентрации выливают на твердую питательную среду, например на агар или чаще на нитроцеллюлозные фильтры, помещенные на чашку Петри с питательной средой, из расчета 5 - 10 бактерий на 1 см2 поверхности. Бактериальная клетка на поверхности фильтра начинает делиться с образованием в итоге маленькой колонии, похожей на шляпку гриба. Эта колония называется клоном,причем из каждой клетки образуется свой клон, все клетки которого имеют свойства бактерии-родоначальника.
Отбор бактерий-трансформантов можно продемонстрировать, используя рассмотренную ранее плазмиду pBR322, содержащую два гена устойчивости к тетрациклину и ампициллину. Для отбора этих бактерий в питательную среду добавляют антибиотик - или ампициллин, или тетрациклин в зависимости от того, какой из генов (blа или tet) остался интактным (неповрежденным) после введения чужеродной ДНК. На такой среде клоны образуют клетки только с плазмидами (рекомбинантными и нерекомбинантными), а все остальные погибают. Для отделения рекомбинантных бактерий от исходных используют следующую технологию. К фильтру с исходными колониями прижимают свежий нитроцеллюлозный фильтр (фильтр-реплика), который затем переносят на чашку Петри с аналогичной питательной средой, но, содержащей антибиотик, ген устойчивости к которому был разрушен при создании рекомбинантов. На этих фильтрах дают клоны только те бактерии, которые содержат исходную плазмиду, а рекомбинантные бактерии их не образуют. Анализируя расположение клонов на исходном фильтре, и фильтре-реплике, выделяют колонии, содержащие трансформированные клетки.
При поиске рекомбинантных клонов успешно применяют метод радиоавтографии, основанный на способности двух любых одноцепочечных комплиментарных фрагментов ДНК спариваться (гибридизоваться) между собой. Если один фрагмент (ДНК-зонд, гибридизационный зонд) содержит радиоактивную метку (обычно изотоп фосфора 32 или иода 125), то радиоактивной будет и гибридизованная молекула ДНК или ее фрагмент.
Технология подготовительного этапа радиоавтографического скрининга имеет много общего с описанной выше процедурой, используемой при клонировании. Полученную с трансформированной бактериальной колонии фильтр-реплику подвергают щелочной обработке при высокой температуре. При этом клетки в колониях лизируются, а клеточная ДНК денатурируется с разрушением двойной спирали и одиночные цепи связываются с нитроцеллюлозой в том участке, где была расположена соответствующая колония. Далее фильтр подвергают обработке раствором, содержащим специально приготовленные, меченные изотопами, одноцепочечные фрагменты клонируемой ДНК а затем промывают для удаления раствора с ДНК-зондом. На тех участках фильтра, где находились трансформированные клетки будет происходить процесс гибридизации клонируемой ДНК с ДНК-зондом и они окажутся радиоактивными.
Рекомбинантные клоны могут быть идентифицированы и по синтезируемому ими продукту. Технически эта процедура имеет много общего с гибридизацией. Все клеточные линии (клоны) высевают на чашки с питательной средой. Выросшие колонии переносят на фильтр, клетки лизируют, а высвободившиеся белки фиксируют на фильтре. Затем на фильтр наносят первые антитела, которые специфически связываются с данным белком (антигеном), все несвязавшиеся антитела удаляют, а фильтр помещают в раствор вторых антител, специфичных в отношении первых антител. Во многих тест-системах используют конъюгаты вторых антител с ферментом, например с щелочной фосфатазой. После отмывания фильтра добавляют бесцветный субстрат. Если вторые антитела связываются с первыми, то под действием фермента происходит гидролиз субстрата с образованием окрашенного вещества в том месте, где идет реакция. Те клетки на чашке, которые соответствуют окрашенным пятнам на фильтре, содержат или полноразмерный ген, или достаточно протяженный его участок, обеспечивающий синтез белкового продукта, узнаваемого первыми антителами. По окончании иммунологического скрининга необходимо дополнительно определить, какой именно из отобранных клонов содержит полноразмерный ген.
Лекция №11
Дата добавления: 2016-01-30; просмотров: 1382;
