Требования к условиям проведения ферментативной реакции
Ферментативная реакция должна проводиться в строго определенных условиях с учетом следующих факторов.
1. Начальная скорость реакции (υo).Скорость ферментативной реакции количественно можно измерить по убыли субстрата или по образованию продукта реакции.
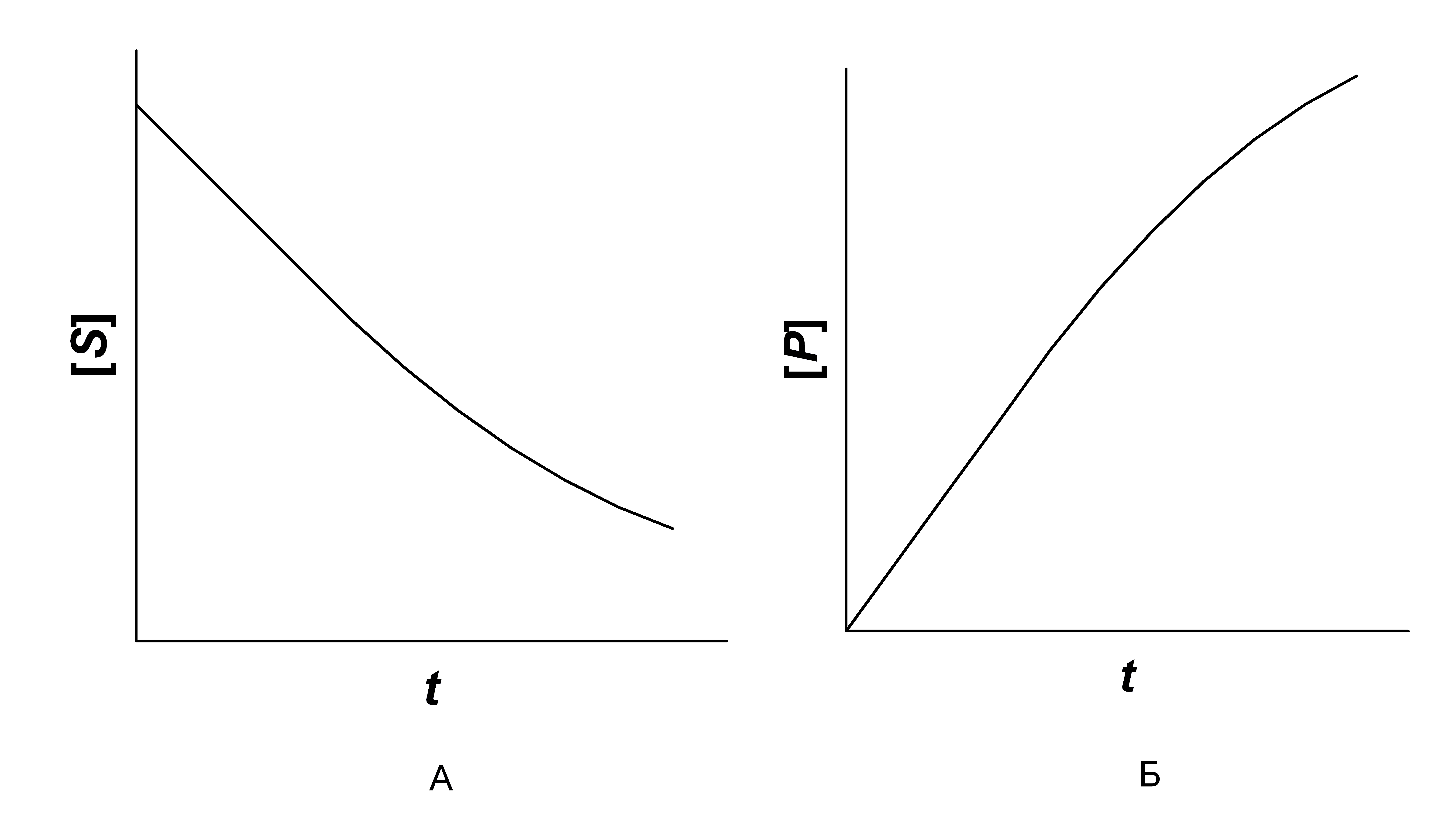
Типичные кинетические кривые ферментативной реакции приведены на рис. 1. Для каждой ферментативной реакции могут быть подобраны условия, при которых начальный участок кривой линеен, т. е. зависимость концентрации образовавшегося продукта или израсходованного субстрата от времени наблюдения имеет прямо пропорциональный характер.
| Время наблюдения, t А |
| Время наблюдения, t Б |
Рисунок 1 – Типичные кинетические кривые ферментативной реакции:
А – регистрация по скорости исчезновения субстрата реакции;
Б – регистрация по скорости образования продукта реакции
Начальная скорость реакции (υo) определяется как тангенс угла наклона линейного участка кривой.
Поскольку длительность прямолинейного участка кинетической кривой от опыта к опыту несколько изменяется, время инкубации (при использовании метода отбора проб) должно составлять не более 70 % и не менее 20% времени соответствующего прямолинейного участка.
2. Концентрация субстрата ([S]0).В большинстве случаев зависимость начальной скорости ферментативной реакции (υo) от начальной концентрации субстрата ([S]0), согласно уравнению Михаэлиса–Ментен (2) описывается гиперболической функцией (рис. 2).
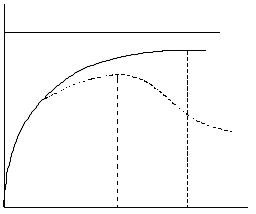
| Рисунок 2 – Зависимость начальной скорости реакции υo от начальной концентрации субстрата [S]0. а – ферментативный процесс, подчиняющийся уравнению Михаэлиса-Ментен; б – процесс, для которого характерно ингибирование фермента субстратом; [S]0 – начальная концентрация субстрата; [S]нас – насыщающая концентрация субстрата; [S]опт – оптимальная концентрация субстрата; Vмакс – максимальная скорость реакции; Км – константа Михаэлиса |
| V макс/2 |
| Kм |
| V макс |
| [S]опт |
| [S]нас |
| [S]0 |
| υ0 |
| а |
| б |
Начальная скорость реакции (υo) зависит от начальной концентрации субстрата ([S]0) вплоть до его насыщающей концентрации. Под насыщающей концентрацией ([S]нас) понимают такую концентрацию субстрата, при которой начальная скорость реакции практически перестает повышаться при дальнейшем увеличении концентрации субстрата, стремясь к своему предельному значению, называемому максимальной скоростью реакции Vмакс (рис. 2). Отрезок на оси абсцисс, соответствующий скорости, равной половине максимальной, будет представлять собой Км. При проведении ферментативной реакции реакционная смесь должна содержать такое количество субстрата, которое обеспечит насыщение фермента в течение всего хода определения (количество субстрата, взятого для проведения ферментативной реакции, должно быть примерно на 30% выше насыщающей концентрации).
Если форма кривой зависимости начальной скорости реакции (υo) от начальной концентрации субстрата ([S]0) отличается от гиперболической, определение параметров по уравнению Михаэлиса–Ментен невозможно. Такие отклонения наблюдаются в случае ингибирования или активации фермента субстратом, а также при работе с аллостерическими ферментами. В этом случае оптимальной является та концентрация субстрата, при которой начальная скорость реакции максимальна ([S]опт)– точка перегиба на экспериментальной кривой зависимости начальной скорости реакции от начальной концентрации субстрата (рис. 2).
После выбора насыщающей концентрации субстрата необходимо проверить, сохраняется ли при ней линейная зависимость [P] от t.
В качестве субстратов используются как природные вещества, такие как альбумин, казеин, крахмал, так и синтетические. Природные субстраты ферментов используют большей частью для подтверждения подлинности. Синтетические субстраты обеспечивают более высокую точность и лучшую воспроизводимость при количественном определении ферментативной активности.
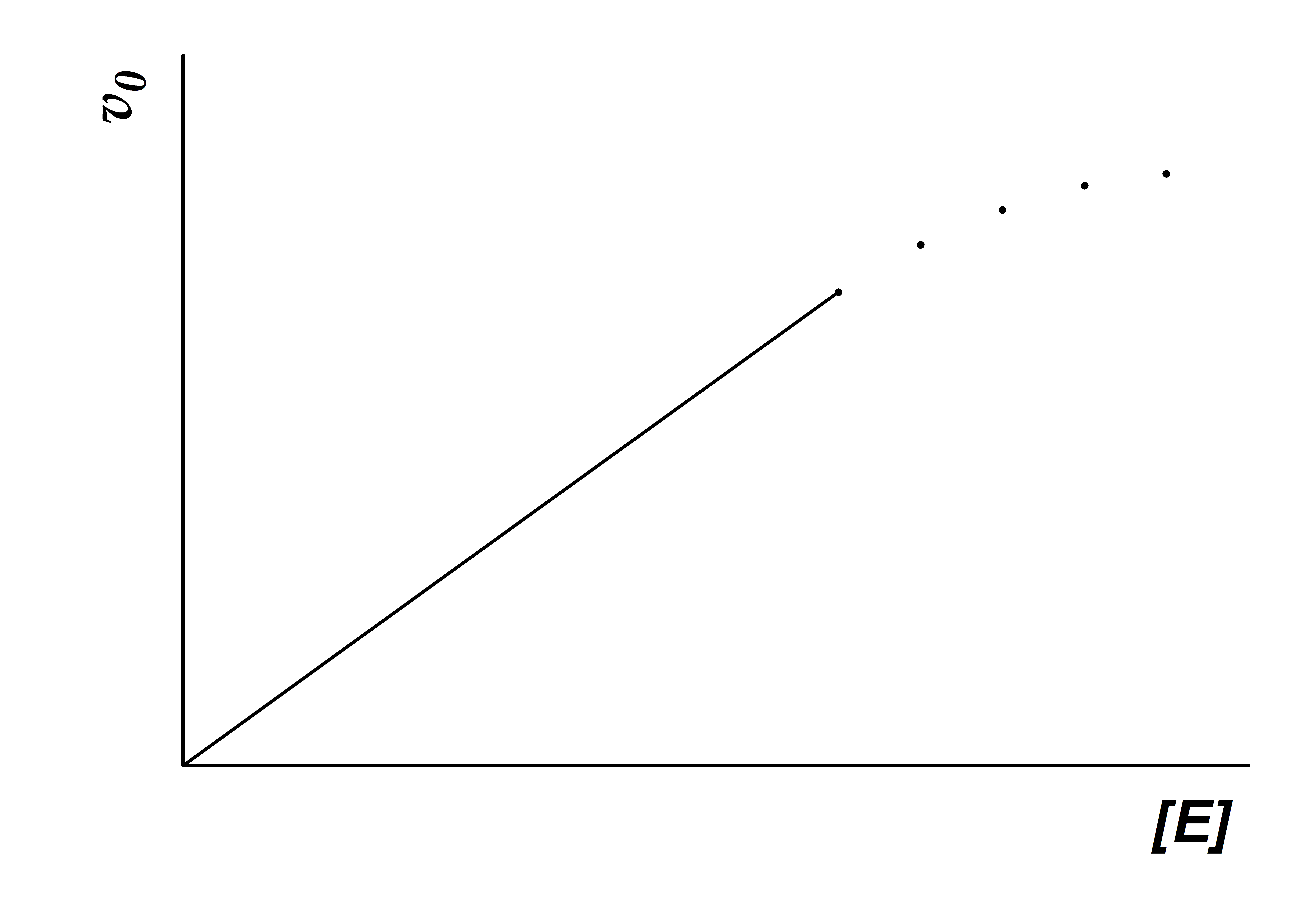
3. Концентрация фермента ([Е]0). В соответствии с уравнением Михаэлиса–Ментен начальная скорость ферментативной реакции (υo) в подавляющем большинстве случаев линейно зависит от концентрации фермента ([E]0). Выбор оптимальной для каждого метода концентрации фермента осуществляется экспериментально при помощи построения кривой зависимости начальной скорости реакции от концентрации фермента (рис. 3).
После выбора начальной концентрации фермента необходимо проверить, сохраняется ли при ней линейная зависимость [P] от t при выбранном значении насыщающей концентрации субстрата.
| υo |
| [E]0 |
Рисунок 3 – Зависимость начальной скорости реакции υ0
от начальной концентрации фермента [E]0
4. Температура. Особенностью ферментативных реакций является наличие колоколообразной зависимости скорости реакции от температуры в достаточно широком интервале температур, которая характеризуется «температурным оптимумом» реакции. Эта особенность объясняется наложением 2 эффектов: возрастанием скорости реакции при увеличении температуры и ускорением тепловой денатурации белковой молекулы, приводящей к инактивации фермента при достаточно высоких температурах. Обычно ферментативную реакцию рекомендуется проводить в термостате при температуре (37 ± 0,1) ºС, если нет иных указаний в фармакопейной статье. Предварительно каждый из реагентов нагревают до температуры
37 ºС.
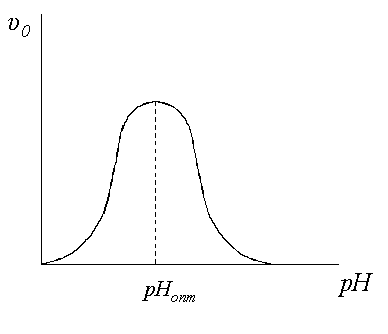
5. Значение рН.Типичная кривая, описывающая для большинства ферментов рН-зависимость начальной скорости ферментативной реакции при наличии 2 ионогенных групп в активном центре фермента, приведена на рис.4.
| pHопт |
| pH |
Рисунок 4 – Зависимость начальной скорости реакции υ0 от значения рН
Определение активности следует проводить при оптимальном значении рН, определенном при выбранных значениях концентрации фермента и насыщающей концентрации субстрата; использовании буферного раствора того состава, который не ингибирует фермент и температуре (37 ± 0,1) ºС, если нет других указаний в фармакопейной статье.
После выбора оптимального значения рН необходимо проверить, сохраняется ли при этом рН линейная зависимость [P] от t при выбранных значениях концентрации фермента и насыщающей концентрации субстрата.
6. Кофакторы.Существуют ферменты, для проявления каталитических свойств которых необходимо присутствие кофакторов – веществ, с помощью которых происходит активация ферментов. Кофакторами могут выступать один или несколько неорганических ионов, таких как Fe2+, Mn2+, Mg2+, Zn2+ или комплексная органическая или металлорганическая молекула, называемая коферментом.
Для определения оптимальной концентрации кофактора следует построить кривую зависимости начальной скорости реакции от начальной концентрации кофактора, аналогичную зависимости начальной скорости реакции от начальной концентрации субстрата, и по этой кривой выбрать насыщающую концентрацию кофактора.
После выбора насыщающей концентрации кофактора необходимо проверить, сохраняется ли при ней линейная зависимость [P] от t.
Конкретные параметры ферментативной реакции указываются в фармакопейных статьях.
Способы детекции
Для количественной регистрации скорости ферментативной реакции используют спектрофотометрические, флюресцентные, хеми- и биолюминесцентные методы детекции, основанные на спектральных свойствах субстрата или продукта реакции, а также детекцию с помощью микрокалориметрических датчиков и биодатчиков (биосенсоров) на основе хеми- и биолюминесценции; электрохимические методы, такие как потенциометрия, амперометрия и др. Для одних видов анализа детекция может проводиться непрерывно в ходе реакции, для других – после ее остановки.
Способ остановки ферментативной реакции должен быть указан в фармакопейной статье.
Дата добавления: 2016-01-30; просмотров: 2688;
