Выполнение испытания
Точную навеску порошка растертых драже или таблеток испытуемого препарата, указанную в соответствующих фармакопейных статьях, количественно переносят в мерную колбу определенной вместимости, доводят объем раствора водой очищенной до метки, перемешивают и фильтруют. Из полученного раствора готовят разведение 1 % раствором натрия цитратаа) так, чтобы концентрация раствора для испытания была близкой к контрольной концентрации раствора стандартного образца (СО) цианокобаламина – 0,05 мкг/мл.
В чашки Петри (6 чашек для построения стандартной кривой и 3 чашки для раствора испытуемого препарата) одинакового диаметра с ровным и плоским дном, установленные на строго горизонтальной поверхности (регулируют по ватерпасу), разливают по 10–12 мл расплавленной и охлажденной до температуры 48 – 50 °С основной среды, засеянной суспензией Escherichia coli 113-3 из расчета от 4 до 6 мл суспензии на 200 мл основной среды. После застывания среды в каждой чашке стерильным бором по трафарету делают лунки в агаре: 6 лунок диаметром 8 мм под углом 60 ° друг к другу.
В 3 лунки (через одну) каждой из 6 чашек, используемых для построения стандартной кривой, и 3 чашек - для раствора испытуемого препарата, вносят по 0,1 мл раствора СО контрольной концентрации (0,05 мкг/мл). В 3 лунки (через одну) каждой из 3 чашек препарата вносят по 0,1 мл одной из концентраций остальных растворов СО, а также раствора испытуемого препарата. Чашки инкубируют при температуре 37 °С в течение 16 – 18 ч.
По окончании инкубации измеряют диаметры зон стимуляции роста тест-микроорганизма для каждой концентрации растворов СО. После измерения зон роста для всех концентраций рассчитывают среднюю величину зоны, учитывая в каждом случае 3 чашки, т. е. 9 зон. Затем рассчитывают среднюю величину зоны для контрольной концентрации, учитывая все чашки (27 зон).
По разности между средней величиной зоны контрольной концентрации раствора (0,05 мкг/мл), рассчитанной из всех чашек, и средней величиной зоны контрольной концентрации раствора СО, полученной из 3 чашек с каждой отдельной концентрацией, находят поправку к величине зоны данной концентрации. Найденную поправку прибавляют к средней величине зоны данной концентрации, если она положительная, и вычитают, если она отрицательная. Аналогичным образом делают поправку к концентрации раствора испытуемого препарата.
Содержание цианокобаламина в 1 драже или 1 таблетке в граммах (X)вычисляют по формуле:
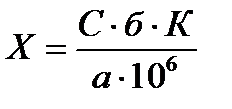
где: С – содержание цианокобаламина в 1 мл испытуемого раствора, найденное по стандартной кривой, мкг;
К – коэффициент разведения;
а – навеска препарата в граммах или количество таблеток;
б – средняя масса одной таблетки, г;
106 – коэффициент для пересчета в граммы.
Построение стандартной (калибровочной) кривой. По исправленным значениям величин зон стимуляции роста при добавлении приготовленных концентраций и средней величине зоны контрольной концентрации на всех чашках строят стандартную кривую, откладывая на оси абсцисс концентрации цианокобаламина в мкг/мл, а на оси ординат соответствующие им величины диаметров зон роста. По полученным точкам строят стандартную кривую, находят концентрацию цианокобаламина в мкг/мл и вычисляют его содержание в образце.
Примечания.
1.Приготовление основного раствора СО цианокобаламина 100 мкг/мл. В мерной колбе вместимостью 250 мл в 25 % спирте растворяют 0,0250 г СО цианокобаламина (в пересчете на сухое вещество), доводят объем раствора тем же растворителем до метки и перемешивают. Раствор годен к использованию в течение 2 мес при температуре 2 – 8 °С во флаконе темного стекла с притертой пробкой.
2. Приготовление рабочего раствора СО цианокобаламина 1 мкг/мл. В мерную колбу вместимостью 100 мл помещают 1,0 мл основного раствора СО цианокобаламина и доводят объем раствора водой очищенной до метки. Раствор годен в течение 5 сут при температуре 2 – 8 °С.
Растворы, содержащие цианокобаламин, не должны подвергаться воздействию прямых солнечных лучей.
Из рабочего раствора СО цианокобаламина в день исследования готовят растворы, содержащие 0,025; 0,050 и 0,075 мкг цианокобаламина в 1 мл. Для этого соответственно 2,5; 5,0 и 7,5 мл рабочего раствора СО помещают в мерные колбы вместимостью 100 мл, доводят объемы растворов в колбах 1 % раствором натрия цитрата до метки и перемешивают.
Раствор, содержащий 0,05 мкг цианокобаламина в 1 мл, принимают за раствор СО контрольной концентрации.
3. Хранение и подготовка тест-культуры для анализа. Культуру тест-микроорганизма выращивают на скошенной агаризованной среде при температуре (32,5 ± 2,5) оС в течение 16–18 ч. Тест-культуру хранят при температуре 2 – 8 оС, пересевая не реже одного раза в месяц.
Состав среды для хранения тест-микроорганизма:
· казеиновый кислотный гидролизат 10 % 6 млб)
· калия фосфат двузамещенный 0,02 г
· железа сульфат 0,0005 г
· магния сульфат 0,02 г
· L-аспарагин 0,02 г
· глицерин 0,2 г
· агар микробиологический 1,5 г
· цианокобаламин 10 мкг
· вода очищенная до 100 мл
рН среды до стерилизации (7,0 ± 0,2)
Приготовление среды. Ингредиенты (гидролизат казеина и соли) последовательно растворяют в воде. Аспарагин растворяют отдельно в 10 мл воды с добавлением 2 капель 1 М раствора хлористоводородной кислоты при слабом нагревании и добавляют к раствору солей. Устанавливают рН 7,0 полученной смеси 15 % раствором натрия гидроксида, после чего доводят объем среды водой очищенной до 100 мл, прибавляют 0,2 г глицерина и 1,5 г агара микробиологического. Смесь нагревают на водяной бане до полного растворения агара, затем прибавляют 10 мкг цианокобаламина.
За 1сут до проведения испытания тест-микроорганизм пересевают на пептонно-солевую среду следующего состава:
А) Пептонно-солевая среда агаризованная:
· пептон ферментативный сухой 2,0 г
· натрия хлорид 0,5 г
· агар микробиологический 1,8 г
· вода очищенная до 100 мл
Б) Пептонно-солевая среда жидкая:
· пептон ферментативный сухой 2,0 г
· натрия хлорид 0,5 г
· вода очищенная до 100 мл
рН среды до стерилизации (7,0 ± 0,2).
Приготовление сред. Жидкую и агаризованную среды разливают в пробирки по 5 мл, стерилизуют насыщенным паром под давлением в паровом стерилизаторе при температуре 120–121 °С в течение 15 мин. Для получения скошенного агара среду охлаждают в наклонном положении На обе среды делают посев тест-культуры E. coli из рабочего музея и инкубируют в течение 16 – 18 ч при температуре (32,5 ± 2,5) °С и используют для приготовления посевного материала.
4. Состав и приготовление основной среды.
Состав основной среды:
· аммония хлорид 2,0 г
· натрия хлорид 3,0 г
· калия фосфат двузамещенный 0,4 г
· натрия цитрат трехзамещенный 3,0 г
· лактоза 3,0 г
· агар микробиологический 15,0 г
· вода очищенная до 1000 мл
рН среды до стерилизации (7,0±0,2)
Приготовление среды. Среду разливают по 200 мл в колбы и стерилизуют насыщенным водяным паром при температуре 120 – 121 °С в течение 15мин. Хранят при температуре 2 – 8 °С не более 2 мес.
Перед розливом в чашки Петри на каждые 200 мл расплавленной среды добавляют по 5 мл стерильного 40 % раствора глюкозы. Раствор глюкозы стерилизуют при температуре 120 – 121 °С в течение 10 мин.
5. Приготовление посевного материала. Со скошенного пептонно-солевого агара (А) делают смыв суточной тест-культуры 0,9 % раствором натрия хлорида или используют бульонную культуру с жидкой питательной среды (Б). Плотность микробной взвеси должна быть (1–2)109 КОЕ/мл.
Вся работа должна выполняться в асептических условиях. В работе используют только химически чистую лабораторную посуду.
Дата добавления: 2016-01-30; просмотров: 1250;
