Чашечные агаровые методы
Для культивирования микроорганизмов используют агаризованные питательные среды: соево-казеиновый агар или среду № 1 сухую для контроля микробной загрязненности – для выращивания бактерий, агар Сабуро с глюкозой или среду № 2 сухую для контроля микробной загрязненности – для выращивания дрожжевых и плесневых грибов.
Для каждого разведения образца используют не менее 2 чашек Петри с определенной средой.
5.1.1. Глубинный метод
В стерильную чашку Петри диаметром 90 мм вносят 1 мл испытуемого образца, приготовленного для анализа. Добавляют 15 – 20 мл расплавленной и охлажденной до температуры (42,5 ± 2,5) оС стерильной агаризованной питательной среды и быстро перемешивают вращательными движениями. При большем диаметре чашек Петри количество среды соответственно увеличивают до 20 – 25 мл. После застывания агара чашки переворачивают и инкубируют посевы.
5.1.2. Двухслойный метод
Расплавленную агаризованную стерильную питательную среду вносят в количестве 15 – 20 мл в стерильную чашку Петри диаметром 90 мм и оставляют до застывания. При большем диаметре чашки Петри количество среды соответственно увеличивают. Поверхность агара в чашке подсушивают.
В пробирку с 4 мл соответствующей расплавленной и охлажденной до температуры (42,5 ± 2,5) оС питательной среды вносят 1 мл образца, приготовленного для анализа, быстро перемешивают содержимое пробирки. Затем содержимое пробирки выливают на поверхность застывшего и подсушенного агара в чашке Петри, равномерно распределяя верхний слой среды вращательными движениями. После застывания чашку переворачивают и помещают в термостат для инкубации.
5.1.3. Поверхностный метод
Расплавленные и охлажденные до температуры (42,5 ± 2,5) оС стерильные питательные среды вносят в количестве 15 – 20 мл в каждую стерильную чашку Петри диаметром 90 мм и оставляют до застывания. При большем диаметре чашек Петри количество среды соответственно увеличивают. Поверхность агара в чашках подсушивают в термостате или ламинарном шкафу.
Образец, приготовленный для анализа, наносят стерильной пипеткой на агар в количестве 0,1 мл и равномерно распределяют шпателем по поверхности среды.
Чашки переворачивают и помещают в термостат для инкубации.
5.1.4. Модифицированный глубинный метод
Образец, приготовленный для анализа, в количестве 1,0 мл вносят в стерильную чашку Петри диаметром 90 мм. Добавляют 7 – 10 мл расплавленной и охлажденной до температуры (42,5 ± 2,5) оС питательной среды и быстро перемешивают вращательными движениями. После застывания агара чашки переворачивают и инкубируют.
5.1.5. Учет и интерпретация результатов, полученных чашечными агаровыми методами
Посевы просматривают ежедневно. Подсчет колоний производят через 48 – 72 ч (предварительный результат) и через 5 сут (окончательный результат).
Для получения достоверных результатов отбирают чашки, в которых число колоний бактерий не превышает 250, а колоний грибов – 50. Если при учете результатов 2 последующих разведений число колоний на чашках находится в указанных выше пределах, рассчитывают результаты из меньшего разведения.
Если в среднем на чашках выросло более 250 колоний бактерий или более 50 колоний грибов, делают ряд дальнейших последовательных разведений образца, выбирая приемлемое для посева значение.
Если на соево-казеиновом агаре (или на среде № 1) дополнительно обнаружены колонии грибов, то их суммируют с числом бактерий и определяют общее число аэробных микроорганизмов, которое установлено для каждой категории ЛС.
Если на питательной среде отсутствует рост микроорганизмов, результаты отмечают в протоколе испытания следующим образом: при посеве ЛС в разведении 1:10 – «В 1 г (или в 1 мл) лекарственного средства содержится менее 10 бактерий (или грибов)»; при посеве ЛС в разведении 1:100 – «В 1 г (или в 1 мл) лекарственного средства содержится менее 100 бактерий (или грибов)» и т.д.
Количество микроорганизмов (N) в 1 г или в 1 мл рассчитывают по формуле:
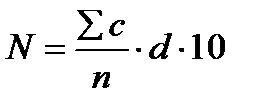 ,
,
где: с – количество колоний на всех чашках Петри;
n – число чашек Петри;
d – коэффициент разведения образца;
10 – коэффициент пересчета при проведении высева на чашку в объеме 0,1 мл.
Пример.При посеве 1,0 мл образца из разведения 10-2 на 2 чашках выросло 168 и 215 колоний:
 .
.
Полученный результат округляют до 2 значащих цифр – 19000 и записывают как 1,9  104 колониеобразующих единиц (КОЕ).
104 колониеобразующих единиц (КОЕ).
При необходимости подсчета общего количества микроорганизмов (бактерий и грибов суммарно) в 1 г или в 1 мл лекарственного средства следует сложить число аэробных бактерий с числом грибов.
Примечания.
В связи с тем, чтоЛРП, представляющие собой лекарственные растения или их части (листья, цветки, трава, плоды, семена, кора, корни, корневища и др.), являются неоднородными в отношении количества аэробных бактерий и грибов, нормы допустимой микробной загрязненности лекарственного растительного сырья интерпретируют следующим образом:
- если количество микроорганизмов в 1 г не более 105 КОЕ – максимально допускается 5  105 КОЕ/г;
105 КОЕ/г;
- если количество микроорганизмов в 1 г не более 107 КОЕ – максимально допускается 5  107 КОЕ/г и т.д.
107 КОЕ/г и т.д.
Для остальных категорий лекарственных препаратов (за исключением ЛРП) нормы допустимой микробной загрязненности интерпретируют следующим образом:
-если количество микроорганизмов в 1 г или в 1 мл не более 102 КОЕ – максимально допускается 2  102 КОЕ/г или мл;
102 КОЕ/г или мл;
- если количество микроорганизмов в 1 г или в 1 мл не более 103 КОЕ – максимально допускается 2  103 КОЕ и т.д.
103 КОЕ и т.д.
Варианты чашечного агарового метода (глубинный, двухслойный и глубинный модифицированный) можно использовать при испытании различных лекарственных форм, независимо от уровня микробной загрязненности. Поверхностный агаровый метод предпочтительнее использовать при испытании ЛС с высоким уровнем микробной контаминации. Для сокращения сроков получения результатов количественного определения бактерий и грибов, колонии которых склонны к сливному росту, используют модифицированный агаровый метод посева.
Дата добавления: 2016-01-30; просмотров: 4611;
