Изомерия комплексных соединений.
Изомеры- вещества, имеющие одинаковый качественный и количественный состав, но разное строение. У комплексных соединений наиболее распространены следующие виды изомерии:
1)Геометрическая (цис - транс) изомерия обусловлена различными положениями лигандов относительно друг друга. Например диамминтетрахлорплатина [Pt(NH3)2Cl4]0
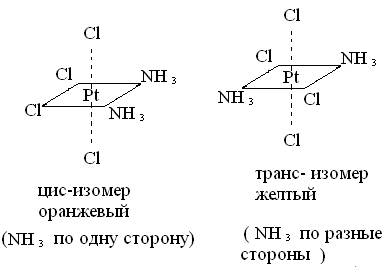
2) Гидратная - обусловлена неодинаковым расположением молекул воды между внутренней и внешней сферами комплексных соединений:
[Cr(H2O)6]Cl3 ; [CrCl2(H2O)4]Cl · 2H2O
3)Ионизационная - неодинаковое распределение кислотных остатков (ионов) между внутренней и внешней сферами комплексных соединений:
[CoBr(NH3)5]SO4 -Сульфат пентаамминбромокобальта (III) - красно-фиолетовый
[CoSO4(NH3)5]Br -Бромид пентаамминсульфатокобальта (III) – красный
4)Координационная:
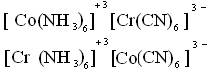
Вопрос 5
Природа химических связей в К.С.
Развитие представлений о природе комплексных соединений тесно связано с созданием и развитием общей теории химической связи. Так в 20-х годах разработаны электростатические представления о химической связи в комплексах. В дальнейшем было разработано 3 квантовомеханических метода:
1) МВС
2) Теория кристаллического поля (ТКП)
3) ММО
Эти методы не являются противоположными друг другу, наоборот они дополняют друг друга, а зачастую приводят к одинаковым результатам.
Дадим объяснения химической связи в комплексах с помощью электростатических представлений. По простой электростатической модели, предложенной немцами Косселем и Магнусом (1916-1922), взаимодействие между комплексообразователем и ионными или полярными лигандами подчиняется закону Кулона. Ион комплексообразователь притягивает к себе как ионы противоположного знака, так и полярные молекулы. С другой стороны, окружающие комплексообразователь частицы отталкиваются друг от друга, при этом энергия отталкивания тем больше, чем больше частиц группируется вокруг центрального иона.
Расчеты Косселя и Магнуса показали также, что при значительном увеличении числа лигандов силы отталкивания между ними настолько возрастают, что комплексы становятся непрочными. Так было найдено, что достаточно прочные комплексы с однозарядными ионами-комплексообразователями должны иметь координационные числа 2и 3, с двухзарядными-4, с трехзарядными-4,6.Эти результаты близки к тому, что наблюдается в действительности.
Таким образом, электростатические представления указали в принципе причину образования комплексных соединений, позволили теоретически оценить их прочность и в первом приближении объяснить наблюдаемые координационные числа. Однако представления о комплексах как агрегатах, состоящих из недеформируемых заряженных сфер, является, конечно, очень грубой моделью и поэтому не может объяснить многих их особенностей. Так, электростатические представления не могут объяснить, почему ряд комплексов с координационным числом 4 имеет плоское строение (Комплексы Pd,Pt и др.). Согласно модели заряженных шаров, энергетически более выгодным является тетраэдрическое расположение 4-х лигандов вокруг комплексообразователя.
Указанная модель не объясняет магнитные свойства комплексных соединений. Вещества, имеющие неспаренные электроны парамагнитны, они втягиваются в неоднородное магнитное поле. Если все электроны спарены, вещество диамагнитно - оно отталкивается магнитом.
Согласно представлениям Косселя и Магнуса, взаимодействие ионов с лигандами не приводит к изменению электронного строения, число неспаренных электронов иона в комплексе должно быть таким же, как у свободного иона. Однако, опыт показывает, что в комплексах это число может быть иным, причем разным в зависимости от природы лигандов. Так, у иона Fe²+ имеется 4 неспаренных электрона, столько же их в комплексе – [FeF6]4- однако в ионе [Fe(CN)6]4- все электроны спарены.
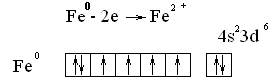
Не может она также объяснить, почему существуют комплексы с неполярными лигандами и комплексообразователи в нулевой степени окисления
МВС.
Очень наглядным способом описания комплексных соединений является МВС, предложенный и разработанный Полингом в 30-х годах, вскоре после создания квантовой механики.
В основе метода лежат следующие положения:
1) Связь между комплексообразователем и лигандами донорно-акцепторная. Лиганды представляют электронные пары, а ядро комплекса- свободные орбитали. Мерой прочности связи служит степень перекрывания орбиталей.
2) Орбитали центрального атома, участвующие в образовании связи, подвергаются гибридизации. Тип гибридизации определяется числом, природой и электронной структурой лигандов. Гибридизация электронных орбиталей комплексообразователя определяет геометрию комплекса.
3) Дополнительное упрочнение комплекса обусловлено тем, что наряду с δ-связями могут возникать и π-связи. Это происходит, если занятая электронами орбиталь центрального атома перекрывается с вакантной орбиталью лиганда.
4) Исходя из заселенности орбиталей объясняются магнитные свойства.
Рассмотрим, как МВС описывает электронную структуру и свойства некоторых комплексов образованных металлами первого переходного ряда: медью, цинком.
Электронные структуры ионов, указанных металлов-комплексообразователей:
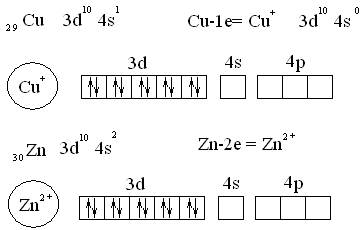
Cu
В пределах валентного слоя у иона меди имеются пустые орбитали, которые и играют роль акцепторов электронных пар. 4s и 4р орбитали иона меди образуют 2 гибридные sp орбитали.
Zn
Образуется 4 sp³ гибридные орбитали. Перекрывание орбиталей центрального атома с орбиталями аммиака можно изобразить упрощенно:
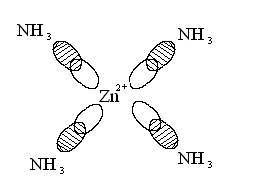
При образовании комплекса распределение электронов на d-орбиталях комплексообразователя может оставаться таким же, как у изолированного иона, или испытывать изменения.
Собственные электронные пары комплексообразователя изображаем стрелками, а электронные пары лигандов, ответственные за донорно-акцепторные σ-связи - пунктирными стрелками.
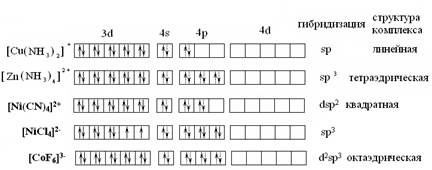
Электронные структуры комплексов правильно отражают их магнитные свойства. Так, [Cu(NH3)2]+; [Zn(NH3)4]²+- диамагнитны, у них нет неспаренных электронов. В противоположность [NiCl4]²- - парамагнитен.
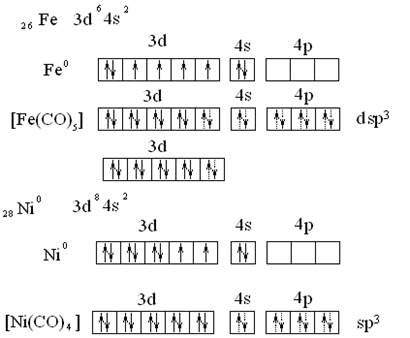
МВС дает возможность трактовать комплексы с нейтральными лигандами. Например, в карбонилах роль комплексообразователей играют атомы переходных металлов с нулевой степенью окисления. Лигандами являются нейтральные молекулы оксида углерода(II). Карбонилы – диамагнитные вещества, поскольку все электроны металла спарены: [Fe(CO)5]; [Ni(CO)4];
Теория кристаллического поля (ТКП) - основывается на чисто электростатической модели. Однако в отличие от теории Косселя и Магнуса здесь рассматриваются изменения в электронных оболочках иона комплексообразователя, происходящие под действием лигандов. Свое название ТКП, получила в связи с тем, что первоначально она была применена для объяснения состояния ионов в кристаллах и затем перенесена на комплексы, в которых ионы так же, как и в кристаллах, окружены соседними частицами.
Согласно ТКП связь между ядром комплекса и лигандами чисто ионная или ион - дипольная. Ионная в смысле электростатического взаимодействия катиона-комплексообразователя и анионов - лигандов.
ТКП объясняет оптические и магнитные свойства соединений. Она применима в случае ионных комплексов. МВС - в случае ковалентных комплексов. ММО - применяется независимо от типа химической связи. Но этот метод математически сложен и ненагляден.
Спектр поглощения в видимой и ультрафиолетовой областях обусловлен переходами электронов с одних энергетических уровней на другие. Спектр поглощения, а следовательно и окраска большинства комплексов d-элементов обусловлен электронными переходами с низшей d-орбитали на d-орбиталь с более высокой энергией.
Вопрос 6
Устойчивость комплексных соединений
Комплексные соединения в растворе ведут себя как сильные электролиты, т.е. полностью диссоциируют на ионы. Идет первичная диссоциация.
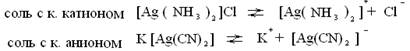
Наряду с этим процессом хоть и в незначительной степени, происходит вторичная диссоциация внутренней сферы комплекса, т.к. комплексный ион является слабым электролитом.
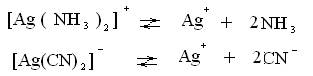
Применим закон действующих масс, к равновесиям диссоциации слабых электролитов, получим выражения констант нестойкости комплексных ионов.
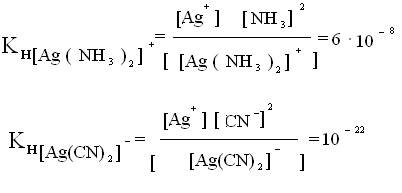
Константа нестойкости есть мера прочности комплекса. Из 2-х приведенных комплексов более устойчив второй, ему отвечает меньшая КН и меньшая равновесная концентрация ионов серебра в растворе. Константы нестойкости сведены в таблицы.
Вместо константы нестойкости иногда пользуются величиной обратной, называемой константой устойчивости Куст = 1/кн, или константой образования комплекса.
Важно отметить, что диссоциация комплексных ионов, аналогично слабым электролитам протекает ступенчато. Например: у комплекса [Ag(NH3)2] отщепляется сначала одна молекула аммиака, а затем вторая.
I ст. [Ag(NH3)2]↔ [Ag(NH3)]+ + NH3 K1 = 6·10-4
II ст. [Ag(NH3)]+↔ Ag+ + NH3 K2 = 1·10-4
Произведения констант последовательных ступеней диссоциации дает полную константу нестойкости данного комплекса:
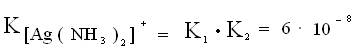
Целый ряд соединений, которые рассматриваются как комплексные имеет малоустойчивую внутреннюю сферу называются двойными солями. Их обозначают не так как комплексные, а как соединения молекул,
например K 2SO 4 · Al 2(SO4)3.
В ацидокомплексе связи между комплексообразователем и лигандами имеют ионный характер. Двойные соли отличаются от комплексных солей диссоциацией комплексного иона. У двойных солей диссоциация комплексного иона полная, а у комплексных солей- незначительная.
Получаются двойные соли посредством кристаллизации из растворов, содержащих указанные ионы.
Так например, из смеси растворов сульфатов натрия и алюминия при выпаривании кристаллизуется двойная соль NaAl(SO4)2·12H2O,называемая алюмо - натриевыми квасцами.
При растворении в воде эта соль диссоциирует на ионы
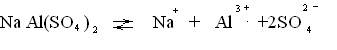
К двойным солям относится соль Мора
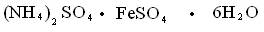
Двойной хлорид калия и меди
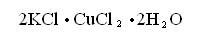
Двойными солями называются продукты замещения атомов водорода в кислотах на два различных катиона.
Одной из самых характерных особенностей химии комплексных соединений является глубокое различие между свойствами простого иона и иона, окруженного лигандами. Ион в растворе, гидратированный отличается от иона-комплексообразователя. Например, в растворе соли CuCl2, ион Cu+2 гидратирован, связан с молекулами воды, но если заменить молекулы воды на молекулы аммиака, то получится комплекс темно синего цвета со свойствами, которых нет у гидратированного иона. Гидратированные ионы Cu2+ слабо окрашены, легко взаимодействуют с ионами карбоната, образуя осадок карбоната меди, практически не реагируют с целлюлозой, а вот комплексные ионы [Cu(NH3)4]²+с ионами СО32-осадка не образуют, а целлюлозу (например вату) в щелочной среде растворяют (на этом основан один из способов получения искусственного шелка).
Различные свойства комплексные ионы имеют и в живых организмах. Гидратированные ионы цинка не влияют на разложение кислых солей угольной кислоты, а комплексное соединение цинка (фермент карбонангидраза), содержащееся в крови ускоряет распад гидрокарбонатов и выделение из крови в легкие диоксида углерода:
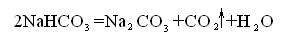
Не будь этого комплекса в организме, мы не могли бы дышать, т.к. освобождение крови от углекислоты проходило бы слишком медленно.
Роль комплексных соединений в живых организмах очень велика. Можно сказать, что почти все ионы, присутствующие в молекулах биологического происхождения K,Na,Ca,Mg,Fe,Cu,Zn,Co,Mo,Mn – «закомплексованы»
. В 50-х годах 20 века образован новый раздел химии - биохимия, изучающая комплексы ионов металлов с белками, нуклеиновыми кислотами, липидами и низкомолекулярными природными веществами. Ее практическое применение связано с синтезом фармакологических препаратов, действие которых обусловлено комплексными ионами металлов.
Дата добавления: 2016-01-29; просмотров: 4148;
