По природе лигандов
По принадлежности к определенному классу соединений
a) Комплексные кислоты
Н[AuCl4]- хлористозолотая кислота
H2 [SiF6]- кремнефтористоводородная кислота
H2 [PtCl6]–хлорплатиновая кислота
H2 [PtCl4] – хлорплатинистая кислота.
б) Комплексные основания
[Ag (NH3)2]OH - гидроксид диамминосеребра (1)
[Cu(NH3)4](OH)2 – гидроксид тетрааммино меди (II)
в) комплексные соли
K2[PtCl4]– хлорплатинит калия
K2[PtCl6] – хлорплатинат калия
K3[Fe(CN)6] – гексацианофферат (III) калия, феррицианид калия
K4[Fe(CN)6] – гексацианоферрат (II) калия, ферроцианид калия
по природе лигандов
а) аквокомплексы -лигандами являются молекулы воды.
[Co(H2O)6]SO4; [Cu(H2O)4](NO3)2
б ) аммиакаты -лигандами являются молекулы аммиака
[Ag(NH3)2]Cl; [Cu(NH3)4]SO4; [Co(NH3)6]Cl2
в) гидроксокомплексы- соединения с ОН --группами в виде лигандов.
K3[Al(OH)6]; Nа 2[Zn(OH)4]
г) ацидокомплексы- содержат в качестве лигандов анионы различных кислот.
Оксалатные H2C2O4 ↔ 2H+ + C2O42- - оксалат ион
Карбонатные CO32-
Цианидные CN-
Нитратные NO3-
3) по знаку заряда комплекса
а) Комплексные катионы
[Co(NH3)6]2+Cl2; [Zn(NH3)4]2+Cl2
б) Комплексные анионы
K2[HgI4]2-; K3Fe[CN)6]3-
в) нейтральные комплексы - не имеют внешней сферы.
[Fe(CO)5]; [Ni(CO)4]; [Co(NH3)3Cl3]
Более сложны бикомплексы - содержат комплексный катион и комплексный анион:
[Co (NH3)6] [Fe (CN) 6]
Особую группу составляют сверхкомплексы, в которых число лигандов превышает координационное число комплексообразователя:
CuSO4 · 5H2O FeSO4 · 7H2O
Для меди координационное число равно 4 и во внутренней сфере координировано 4 молекулы воды, пятая присоединяется к комплексу при помощи водородных связей, и связана, поэтому менее прочно.
Дентантность(координационная емкость) лиганда - это число координационных мест, которое может занимать данный лиганд. Дентантность определяется числом донорных атомов, входящих в его состав. Лиганды, содержащие 2 и более донорных атомов называют полидентантными.
Число монодентантных лигандов в координационной сфере равно координационному числу комплексообразователя.
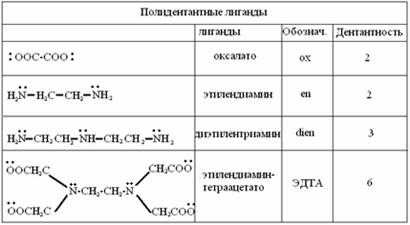
Многие комплексные соединения, содержащие полидентантные лиганды, являются хелатами. Лиганды захватывают комплексообразователь подобно клешне рака (греч. Chele – клешня).
Лиганд присоединяется к комплексообразователю одновременно двумя типами связей- ионной и ковалентной, возникшей по донорно- акцепторному механизму (стрелка от донора к акцептору). Комплексообразователь как бы втянут внутрь лиганда, охвачен связями наподобие клешни рака, отсюда и название (хелат).
Пример хелата - это двунатриевая соль этилендиаминтетрауксусной кислоты, известная под названием трилона Б (или комплексон III)
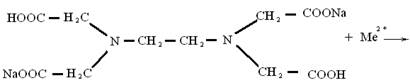
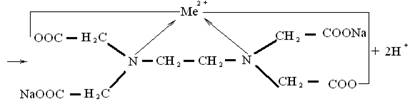
Образование комплексоном III внутрикомплексного соединения с каким-нибудь двухзарядным катионом происходит путем замещения металлом атомов водорода карбоксильных групп и одновременного взаимодействия катиона с атомами азота аминогруппы (за счет координационной связи).
Комплексон III получил широкое распространение в химическом анализе, потому что он образует внутрикомплексные соли с катионами двухвалентных металлов (Ca2+, Mg2+, Ba2+) которые очень трудно перевести в комплексные соединения другими способами. Метод количественного определения металлов комплексонами называется комплексонометрией.
К хелатным соединениям относятся такие важные для жизни вещества, как хлорофилл и гемоглобин. Структурные формулы этих веществ очень сложные, но схематично хлорофилл изображают так:
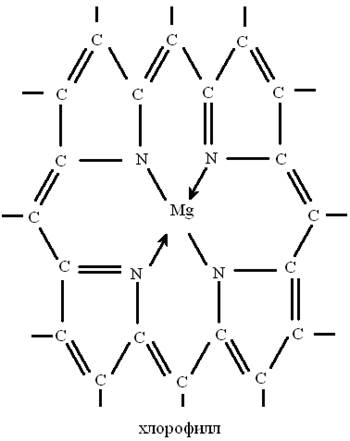
Хлорофилл - комплексное соединение магния, придающее зеленый цвет листьям растений. Ион магния связан в порфириновом кольце с 4-мя атомами азота. При участии зеленого вещества хлорофилла - осуществляется процесс фотосинтеза: растения поглощают солнечную энергию и ассимилируют оксид углерода (IV) из воздуха и воду в углеводы и кислород.
Суммарную реакцию фотосинтеза можно записать:
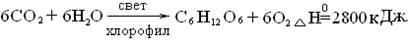
Без хлорофилла жизнь на Земле невозможна. В результате фотосинтеза ежегодно образуется около 10 ¹² кг. крахмала и выделяется в атмосферу примерно столько же кислорода.
Структура гемоглобина идентична, но комплексообразователем является железо.
Свободные ионы металлов в организме не существуют - это либо их гидраты, либо продукты гидролиза. В биохимических реакциях d-элементы наиболее часто проявляют себя как металлы - комплексообразователи. Лиганды -биологически активные вещества, органического характера или анионы неорганических кислот.
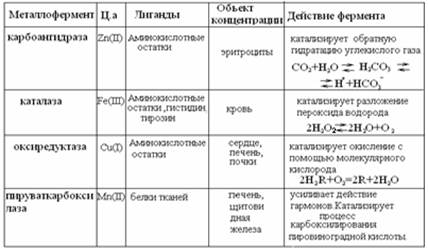
Наиболее известные металлоферменты: карбоангидраза, каталаза, карбоксипептидаза, пероксидаза и др.
Вопрос 3
Номенклатура К.С.
В настоящее время наиболее употребительны 2 номенклатуры К.С.: одна была разработана Вернером, другая - комиссией по номенклатуре неорганических соединений Международного союза по теоретической и прикладной химии. Названия К.С. образуются следующим образом:
1) сначала называют анион,
2) затем катион в родительном падеже и как у простых солей справа налево перечисляют все составные части.
Название комплексного катиона составляют так: сначала указывают число, (используя греческие числительные ди, три, тетра, гекса и т.д.) и названия нейтральных лигандов, вода - аква, аммиак - аммин, затем числа и названия отрицательно заряженных лигандов с окончанием «о» (Cl- - хлоро, SO4- - сульфато, ОН- -гидроксо) последним указывают комплексообразователь, указывая степень его окисленности (в скобках римскими цифрами после названия комплексообразователя).
Название комплексного аниона составляют аналогично названию катиона, но степень окисленности комплексообразователя указывают перед его названием. Окончание у комплексного аниона «АТ».
Названия нейтральных комплексов образуют, так же как и катионов, но комплексообразователь называют в именительном падеже, а степень окисленности не указывают, т.к. она определяется электроотрицательностью комплекса.
K3[Fe(CN)6] – гексацианноферрат (III) калия
K[Ag(CN)2] – дицианоаргентат (I) калия
[Al(H2O)6]Cl3 – хлорид гексааквааллюминия
K[Co+3(NH30)4CO3]+Cl- - хлорид карбонато-тетраамминкобальта (III)
K[Co+3(NH3)2(NO2)4] - тетранитродиамминкобальта (III) калия
[Pt(NH3)2Cl4]0 – тетрахлордиаммин платина
Вопрос 4
Дата добавления: 2016-01-29; просмотров: 3342;
