В классической статистической физике выводится
закон Больцмана о равномерном распределения энергии по степеням свободы молекул: для статистической системы, находящейся в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная kT/2, а на каждую колебательную степень свободы – в среднем энергия, равная kТ.
Колебательная степень «обладает» вдвое большей энергией потому, что на нее приходится не только кинетическая энергия (как в случае поступательного и вращательного движений), но и потенциальная, причем средние значения кинетической и потенциальной энергий одинаковы. Таким образом, средняя энергия молекулы
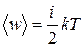 , (11.2)
, (11.2)
где i – сумма числа поступательных, вращательных и удвоенного числа колебательных степеней свободы молекулы.
В классической теории рассматривают молекулы с жесткой связью между атомами; для них i совпадает с числом степеней свободы молекулы.
Так как в идеальном газе взаимная потенциальная энергия молекул равна нулю (молекулы между собой не взаимодействуют), то внутренняя энергия, отнесенная к одному молю газа, будет равна сумме кинетических энергий NА молекул:
Um 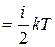 NА. (11.3)
NА. (11.3)
Внутренняя энергия для произвольной массы т газа
U 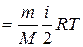
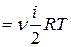 , (11.4)
, (11.4)
где Μ — молярная масса газа, ν — количество вещества.
Дата добавления: 2016-01-29; просмотров: 976;
