Работа газа при изменении его объема
 Для рассмотрения конкретных процессов найдем в общем виде внешнюю работу, совершаемую газом при изменении его объема. Рассмотрим, например, газ, находящийся под поршнем в цилиндрическом сосуде (рис.11.2).
Для рассмотрения конкретных процессов найдем в общем виде внешнюю работу, совершаемую газом при изменении его объема. Рассмотрим, например, газ, находящийся под поршнем в цилиндрическом сосуде (рис.11.2).
Если газ, расширяясь, передвигает поршень на бесконечно малое расстояние dl, то производит над ним работу
δA=Fdl=pSdl=p dV,
где S — площадь поршня, Sdl=dV— изменение
Рис.11.2 объема системы. Таким образом,
δA=p dV. (11.7)
Полную работу А, совершаемую газом при изменении его объема от V1до V2 найдем интегрированием формулы (11.7):
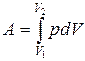 (11.8)
(11.8)
 Результат интегрирования определяется характером зависимости между давлением и объемом газа. Найденное для работы выражение справедливо при любых изменениях объема твердых, жидких и газообразных тел.
Результат интегрирования определяется характером зависимости между давлением и объемом газа. Найденное для работы выражение справедливо при любых изменениях объема твердых, жидких и газообразных тел.
Произведенную при том или ином процессе работу
Рис.11.3 можно изобразить графически с помощью кривой в координатах р,V. Пусть изменение давления газа при его расширении от объема V1 до объема V2 изображается кривой на рис.11.3.
При увеличении объема на dV совершаемая газом работа равна pdV,т. е. определяется площадью полоски с основанием dV,заштрихованной на рис.11.3. Поэтому полная работа, совершаемая газом при расширении от объема V1до объема V2 определяется площадью, ограниченной осью абсцисс, кривой p=f(V)и прямыми V1и V2.
Графически можно изображать только равновесные процессы – процессы, состоящие из последовательности равновесных состояний. Они протекают так, что изменение термодинамических параметров за конечный промежуток времени бесконечно мало. Все реальные процессы неравновесны(они протекают с конечной скоростью), но в ряде случаев неравновесностью реальных процессов можно пренебречь (чем медленнее процесс протекает, тем он ближе к равновесному). В дальнейшем рассматриваемые процессы будем считать равновесными.
Теплоемкость
Удельная теплоемкость вещества – величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К:
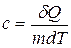 . (11.9)
. (11.9)
Единица удельной теплоемкости — джоуль на килограмм-кельвин (Дж/(кг×К)).
Молярная теплоемкость – величина, равная количеству теплоты, необходимому для нагревания 1 моль вещества на 1 К:
Cm= 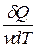 ,(11.10)
,(11.10)
где: v=m/M — количество вещества.
Единица молярной теплоемкости — джоуль на моль·кельвин (Дж/(моль·К)). Удельная теплоемкость с связана с молярной Сm соотношением
Сm = сМ,(11.11)
Различают молярные теплоемкости при постоянном объеме СVи постоянном давлении Ср, если в процессе нагревания вещества его объем или давление поддерживается постоянным.
Запишем выражение первого начала термодинамики (11.6) для 1 моль газа
CmdT = dUm + pdVm.(11.12)
Если газ нагревается при постоянном объеме, то работа внешних сил равна нулю (см. 11.7) и сообщаемая газу извне теплота идет только на увеличение его внутренней энергии:
СV= 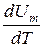 ,(11.13)
,(11.13)
т. е. молярная теплоемкость газа при постоянном объеме СV равна изменению внутренней энергии 1 моль газа при повышении его температуры на 1 К
CV =iR/2. (11.14)
Если газ нагревается при постоянном давлении, то выражение (11.12) можно записать в виде
CV = 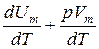 .
.
Учитывая, что 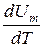 не зависит от вида процесса (внутренняя энергия идеального газа не зависит ни от р, ни от V, а определяется лишь температурой Т)и всегда равна CV , дифференцируя уравнение Клапейрона - Менделеева pVm=RT по Τ (р=const),получаем
не зависит от вида процесса (внутренняя энергия идеального газа не зависит ни от р, ни от V, а определяется лишь температурой Т)и всегда равна CV , дифференцируя уравнение Клапейрона - Менделеева pVm=RT по Τ (р=const),получаем
Сp = СV+R. (11.15)
Выражение (11.15) называется уравнением Майера; оно показывает, что Ср всегда больше СV на величину молярной газовой постоянной. Это объясняется тем, что при нагревании газа требуется еще дополнительное количество теплоты на совершение работы расширения газа, так как постоянство давления обеспечивается увеличением объема газа. Использовав (11.14), выражение (11.15) можно записать в виде:
Сp= 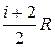 .(11.16)
.(11.16)
При рассмотрении термодинамических процессов важно знать характерное для каждого газа отношение Ср к СV:
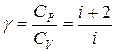 . (11.17)
. (11.17)
Из формул следует, что молярные теплоемкости определяются лишь числом степеней свободы и не зависят от температуры. Это утверждение молекулярно-кинетической теории справедливо в довольно широком интервале температур лишь для одноатомных газов. Уже у двухатомных газов число степеней свободы, проявляющееся в теплоемкости, зависит от температуры. Молекула двухатомного газа обладает тремя поступательными, двумя вращательными и одной колебательной степенями свободы.
 По закону равномерного распределения энергии по степеням свободы, для комнатных температур CV=7/2R. Из качественной экспериментальной зависимости молярной теплоемкости СV водорода (рис.11.4) следует, что оназависит от температуры: при низкой температуре (ниже 50 К) CV =1/2 R,при
По закону равномерного распределения энергии по степеням свободы, для комнатных температур CV=7/2R. Из качественной экспериментальной зависимости молярной теплоемкости СV водорода (рис.11.4) следует, что оназависит от температуры: при низкой температуре (ниже 50 К) CV =1/2 R,при
Рис.11.4 комнатной — CV = 3/2R (вместо расчетных 7/2 R) и при очень высокой — СV = 7/2 R. Это можно объяснить, предположив, что при низких температурах наблюдается только поступательное движение молекул, при комнатных — добавляется их вращение, а при высоких — к этим двум видам движения добавляются еще и колебания молекул.
Дата добавления: 2016-01-29; просмотров: 1945;
