Чувствительности рН среды
Около 5% казеинов в виде мономеров и полимеров фракций казеина и субмицелл размером менее 20 нм не осаждаются при ультрацентрифугировании из обезжиренного молока. Эту форму казеина называют растворимым). Неказеиновые белки, остающиеся в растворимом состоянии после изоэлектрического осаждения казеина, называются сывороточными.
Казеиновая фракция и сывороточные белки с помощью электрофоретических методов разделяются примерно на 30 зон, имеющих различную электрофоретическую подвижность. Фракции казеина обозначают буквами греческого алфавита (a; b; κ; g), указывающими на последовательность их расположения на электрофореграмме. Самую высокую скорость передвижения имеет a-казеин.
Целенаправленные исследования фракционного состава казеина позволили определить, что каждая из фракций казеина представляет собой комплекс основных и минорных фракций, включая генетические варианты. Генетические варианты предполагают существование обусловленных наследственностью различных форм определенного белка. Генетические варианты белков молока отличаются по своей первичной структуре (расположением аминокислот в полипептидной цепи, реже из полипептидной цепи «вычеркивается» один или несколько аминокислотных остатков). Образование этих фракций связано с наследственными факторами, то есть обусловлено генетически. Генетические варианты обозначают буквами латинского алфавита: А; В; С и т.д.
В настоящее время принято считать, что в молоке коров содержится шесть главных белков: aS1-казеин, aS2-казеин, b-казеин, κ-казеин, b-лактоглобулин и a-лактальбумин.
Фракционный состав казеина представлен на рис. 5.1.
Общая характеристика фракций казеина. Все фракции казеина синтезируются в молочной железе, имеют генетические варианты, являются фосфоротеидами, а κ-казеин относится к фосфогликопротеидам (фосфатные группы присоединяются к остаткам оксиаминокислоты – серина). Все фракции казеина характеризуются значительной термоустойчивостью в отличие от сывороточных белков и выдерживают кипячение в течение нескольких часов.
aS1-Казеин– основная фракция aS-казеинов, состоит из простой полипептидной цепи, содержащей 199 аминокислотных остатков, 8 остатков фосфорной кислоты; подобно b-казеину и в отличие от κ-казеина не содержит цистеина, имеет повышенное содержание аспарагиновой кислоты, лизина и тирозина, осаждается под действием ионов кальция (кальцийнеустойчивая фракция); имеет пять генетических вариантов (А, В, С, Д, Е).
aS2-Казеин содержит 207 аминокислотных остатков, имеет четыре генетических варианта, отличающихся степенью фосфорилирования (содержат от 10 до 13 фосфосериновых остатков); в отличие от aS1-казеина и подобно κ -казеину содержит два остатка цистеина;
осаждается под действием ионов кальция – кальцийнеустойчивая фракция.
 Казеин
Казеин
(78-85% от всех белков молока)
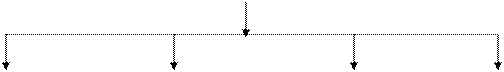 |






Группа b-казеин κ-казеин Группа
aS-казеинов А1А2А3В С Д Е АВ γ-казеинов –
(43-55%) (24-35%) (8-15%) фрагментов
B-фракции
(3-7%)
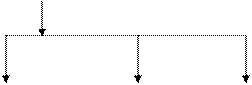 | 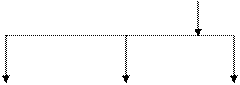 |






aS1-казеин aS2-казеин aS0-казеин γ 1-казеин γ 2-казеин γ 3-казеин
АВСДЕ АВСД А1А2А3В А2А3В АВ
Примечание: Содержание фракций казеина приведено в процентах от содержания казеина
Рис. 5.1. Фракционный состав казеина
aS0-Казеин имеет структуру идентичную структуре aS1-казеина за исключением расположения фосфатных групп, содержание этой фракции – около 10% содержания aS1-казеина.
b-Казеин представлен полипептидной цепью из 209 аминокислотных остатков, которая содержит пять остатков фосфорной кислоты; имеет семь генетических вариантов. Фракция характеризуется повышенным содержанием валина, лейцина, пролина, содержит меньше аланина и аспарагиновой кислоты при отсутствии цистеина. b-Казеин осаждается в присутствии ионов кальция при температуре 35оС, а в охлажденном состоянии (4оС) – не чувствителен к их действию. В отличие от aS-казеинов, b-казеин растворим при низких температурах и может в значительных количествах переходить из мицелл казеина (без видимого их нарушения) в плазму молока и частично гидролизоваться под действием плазмина молока. В результате гидролиза образуются фрагменты b-казеина, которые называют γ-казеинами и компоненты протеозо-пептонов с более низкой молекулярной массой. Поэтому Комитетом по номенклатуре белков (ADSA)
рекомендуется называть γ-казеины и компоненты 5 и 8 протеозо-пептонов b-казеинами, указывая в скобках аминокислотную последовательность соответствующего фрагмента.
Следует особо отметить способность b-казеина, как и aS-казеинов осаждаться в присутствии ионов кальция, что имеет большое практическое значение при сычужном свертывании молока (под действием сычужного фермента и в присутствии ионов кальция) в производстве сычужных сыров. От содержания этих фракций в молоке зависят скорость процесса свертывания, реологические свойства получаемых сгустков, поведение их при дальнейшей обработке и, как следствие, выход и качество готового продукта.
κ-Казеин. Главный компонент κ-казеина представлен полипептидной цепью, состоящей из 169 аминокислотных остатков, в том числе двух остатков цистеина. κ-Казеин в отличие от as- и b-казеинов содержит только один фосфосериновый остаток, поэтому практически не присоединяет ионы кальция, то есть не теряет растворимости в их присутствии и является кальцийустойчивой фракцией. Хорошую растворимость κ-казеина обусловливают также присутствующие в его составе гликолизированные компоненты (гликомакропептиды), в состав которых входят N-ацетилгалактозамин, галактоза и N-ацетилнейраминовая (сиаловая) кислота, содержащие большое количество лиофильных ОН-групп. Гликомакропептиды содержат в своем составе много серина, треонина и глутаминовой кислоты и характеризуются высоким отрицательным зарядом. При ассоциации с aS- и b-казеинами κ-казеин образует стабильные мицеллы и, располагаясь большей частью на поверхности последних, выполняет роль защитного коллоида по отношению к этим кальцийнеустойчивым фракциям, то есть предотвращает их осаждение ионами кальция в свежем молоке.
κ-Казеин не гидролизуется плазмином в отличие от b-казеина, но содержит чувствительную к химозину (сычужному ферменту)пептидную связь, образованную остатками фенилаланина в положении 105 и метионина в положении 106. Продуктами гидролиза κ-
казеина являются гидрофобной пара-κ-казеин (аминокислотные остатки с 1 по 105) и гидрофильные гликомакропептиды (аминокислотные остатки со 106 до 169).
Воздействие сычужного фермента на поверхностную фракцию мицелл казеина - κ-казеин - с последующими его гидролизом, потерей отрицаительноо заряда и дестабилизацией кальцийнеустойчивых aS- и b-казеинов положено в основу сычужного свертывания молока в производстве сычужных или кислотно-сычужных сыров.
Группа γ-казеинов. Как уже отмечалось (см.характеристику b-казеина) Комитетом по номенклатуре (ADSA) рекомендовано называть γ-казеины b-казеинами с указанием в скобках параметров фрагмента этой фракции. Например: γ1 -казеин следует называть - b-Кн (фрагмент 29…209); γ2-казеин - b-Кн (фрагмент 106…209), γ3-казеин - b-Кн (фрагмент 108…209).
На рисунке 5.1 настоящего пособия группа γ-казеинов обозначена просто как фрагменты b-казеина без указания параметров фрагмента с сохранением буквенного обозначения фракции – «γ», что можно объяснить широким распространением названия этой группы казеинов в отраслевой научной, научно-практической и производственной литературе.
В свежем молоке здоровых коров содержание γ-казеинов составляет от 3 до 7%. Особенностью γ-казеинов является то, что под действием сычужного фермента белки этой фракции не осаждаются и уходят в сыворотку. То есть увеличение содержания γ-казеинов в молоке приводит к снижению степени использования белков в производстве продуктов, в основу технологии которых положено сычужное свертывание (сычужные сыры, казеин сычужный, отдельные виды творога).
Сывороточные белки – это белки молока, оставшиеся в сыворотке после осаждения казеина из сырого обезжиренного молока при подкислении его до рН 4,6 и температуре 20оС. Сывороточные белки фракционируют не только по их электрофоретической подвижности, но и по их растворимости в растворах солей и при разной температуре.
Основными сывороточными белками принято считать b-лактоглобулин, массовая доля которого от общего содержания этих белков составляет от 50 до 54%, и a-лактальбумин – от 20 до 25%. Остальное количество сывороточных белков приходится на альбумин сыворотки крови, иммуноглобулины, термостабильные сывороточные белки и другие минорные белки.
В отличие от казеинов, сывороточные белки не ассоциируют друг с другом, не осаждаются в изоэлетрической точке (рН 4,6), их полипептидные цепи не содержат фосфора, отличаются высоким содержанием серосодержащих аминокислот, низким содержанием пролина, поэтому имеют глобулярную конформацию со значительным количеством a-спиральных участков. В силу малого размера частиц сывороточных белков их количество во много раз превышает число казеиновых мицелл.
Сывороточные белки не гидролизуются плазмином и сычужным ферментом, по сравнению с казеином менее чувствительны к кальцию, но более чувствительны к нагреванию. Нагревание молока или сыворотки вызывает их денатурацию – изменение структуры (развертывание полипептидных цепей) с последующим взаимодействием друг с другом и с c-казеином казеиновых мицелл. Образующиеся комплексы влияют на технологические свойства молока: термоустойчивость и способность к сычужному свертыванию.
Фракционный состав сывороточных белков (в % к общему содержанию) приведен на рисунке 5.2.
Лактальбуминовая фракция – фракция термолабильных сывороточных белков, не осаждающаяся при полунасыщении сульфатом аммония или насыщении сульфатом магния. К белкам этой фракции относятся b-лактоглобулин, a-лактальбумин и альбумин сыворотки крови. b-Лактоглобулин и a-лактальбумин – это основные сывороточные белки.
b-Лактоглобулин. Является одним из главных в количественном отношении сывороточных белков (на его долю приходится от 50 до 54% всех белков сыворотки).b-Лактоглобулин состоит из 162 аминокислотных остатков, имеет семь генетических вариантов, в молоке находится в виде димера. b-Лактоглобулин не растворяется в воде, а только в разбавленных растворах солей. Содержит свободные сульфгидрильные (-SH) группы в виде остатков цистеина, которые участвуют в образовании привкуса кипяченого молока при его тепловой обработке. При тепловой обработке часть b-лактоглобулина в денатурированном виде выпадает в осадок вместе с фосфатами кальция

Дата добавления: 2016-01-20; просмотров: 1514;
