Физико-химические свойства белков
Казеин как казеинаткальцийфасфатный комплекс.Важным физико-химическим свойствам казеина является то, что в молоке казеин содержится в виде казеинатов кальция, соединенных с коллоидным фосфатом кальция.
Ионы кальция могут присоединяться к карбоксильных группам казеина:
R – COOH + Ca2+ → R – COOCa+
R - COO
2R – COOH + Ca2+ → Ca
R - COO
Но, вероятно, в первую очередь они взаимодействуют с остатками фосфорной кислоты казеина. При этом кальций может соединяться с одной или двумя ОН-группами кислоты:

 OH O – Ca+
OH O – Ca+
R - CH2 – O – P = O + Ca2+ → R – CH2 – O – P = O
OH OH
Казеин Казеинат кальция

 ОН О О
ОН О О
R - CH2 – O – P = O + Ca2+ → R – CH2 – O – P Са ОН О
Казеин Казеинат кальция
В первом случае кальций имеет свободную валентность и может образовывать кальциевый мостик между серинфосфатными группами двух молекул казеина:

 O – Ca – O
O – Ca – O
R - CH2 – O – P = O O = P – O – CН2 - R
OH HO
К серинфосфатным группам казеиновых молекул наряду с ионами кальция может присоединяться коллоидный фосфат кальция молока в виде [Ca3(PO4)2]n или [CaHPO4]n (точный состав коллоидного фосфата кальция не выяснен).
O


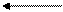 Ca – O – P – O – Ca
Ca – O – P – O – Ca
O OH O
 R – CH2 – O – P = O O = P – O – CH2 – R
R – CH2 – O – P = O O = P – O – CH2 – R
OH OH
Органич Неорган
Следовательно, казеин в молоке содержится в виде сложного комплекса казеината кальция с коллоидным фосфатом кальция, так называемого казеинаткальцийфосфатного комплекса – ККФК.
К физико-химическим свойствам белков относятся также электрические свойства и растворимость, оптические свойства, денатурация.
Электрические свойства и растворимость. При формировании структуры белков на поверхности их частиц остаются свободные функциональные группы, которые в водной фазе диссоциируют и образуют ионы. Ионизированные группы и придают молекулам белка свои электрические свойства. Например, карбоксильные и фосфатные группы отдают протоны и переходят в форму анионов:
R – COOH ↔ R – COO- + H+ ;
OH O-
R – O – P = O ↔ R – O – P = O + 2H+ ;
OH O-
Аминогруппы могут присоединять протоны и переходит в форму катионов: R – NH2 + H+ ↔ R – N+H3.
Этим объясняется определенный заряд нативных белков и их электроориентация (на поверхности нативных белков преобладает отрицательный заряд, что обусловливает их кислые свойства).
От числа электрических зарядов и их соотношения на поверхности белковых частиц зависят важные свойства белков:
- способность к гидратации и растворению, с образованием коллоидных растворов;
- способность передвигаться в электрическом поле;
- их кислый или основной характер;
- способность к образованию солей.
Белки характеризуются высокой степенью гидратации за счет сил электростатического взаимодействия между их полярными группами и дипольными силами молекул воды. Образовавшаяся вокруг белковых частиц гидратная оболочка препятствует агрегации молекул белка в нативном состоянии и коагуляции. Наличие ее и прочность является одним из факторов устойчивого коллоидного состояния белков. Белки из-за наличия на поверхности большого количества ионизированных групп относятся к самым активным водосвязывающим компонентам многих биологических систем. Чем больше зарядов несут белки, тем больше воды они могут присоединить и тем стабильнее они в растворе.
Способность белков связывать воду необходимо учитывать при производстве кисломолочных продуктов, сухих молочных продуктов, а также при выборе влажностных режимов хранения последних.
Число зарядов и их соотношение на поверхности белковых частиц определяет их растворимость, скорость передвижения в электрическом поле и является основой электрофоретического разделения белков и их идентификации.
Количество зарядов, а следовательно растворимость, зависит от ряда факторов, в первую очередь, от рН водной среды, в которой находится частица белка. Ионизированные функциональные группы подчиняются закономерностям равновесных реакций и определяются величиной КD (константой диссоциации):
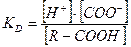
С повышением концентрации водородных ионов в среде диссоциация карбоксильных групп для сохранения равновесия несколько замедляется. R – COOH ↔ R – COO- + H+. При очень низком рН карбоксильные группы присутствуют в недиссоциированной форме. В щелочной области рН они, напротив, полностью диссоциированы.
При снижении величины рН в молоке ионы водорода в соответствии с условиями равновесия будут связываться с ионизированными карбоксильными группами и число отрицательных зарядов на поверхности белковых частиц будет уменьшаться. Вследствие потери заряда (отрицательного) будет нарушаться и гидратная оболочка, а следовательно ухудшаться растворимость белка. При достижении величины рН равной 4,6 (изоэлектрическая точка белка), белок выпадает в осадок.
При дальнейшем повышении концентрации ионов водорода в среде на поверхности белковых частиц происходит протонизация аминогрупп, суммарный заряд вновь повышается, но преобладающим зарядом является уже положительный заряд. При таких условиях белок вновь растворяется. Изменения соотношения зарядов на поверхности белковой частицы схематично представлены на рис. 5.6.
Таким образом, в изоэлектрической точке (рН 4,6) количество зарядов на поверхности белковых частиц оказывается незначительным и поэтому гидратация белка в таких условиях проявляется наиболее слабо и стабильность белка самая низкая. В изоэлектрической точке белки обладают резко выраженной способностью к осаждению, то есть величина рН обусловливает определенное состояние белков: в растворимой форме или в осадке.
Рис. 5.6. Изменения соотношения зарядов на поверхности белковой частицы при снижении величины рН (схематически):
а – снижение рН до изоэлектрической точки;
б – снижение рН за пределы изоэлектрической точки
Свойство белков изменять растворимость при снижении величины рН среды до изоэлектрической точки составляет суть кислотной коагуляции белков, положенной в основу производства всех кисломолочных продуктов: напитков, творога, сметаны, отдельных видов сыров.
В щелочной области рН карбоксильные группы полностью диссоциируют и белок находится в растворенном состоянии.
Вторым фактором, влияющим на растворимость белков является концентрация солей кальция и магния в системе. При невысокой концентрации солей (уровень, соответствующий таковому в молоке) растворимость белков хорошая. Белки адсорбируют ионы кальция и магния на своей поверхности, за счет чего повышается их суммарный заряд и упрочняются гидратные оболочки. Очень высокие концентрации солей оказывают противоположное действие. Ионы кальция и магния конкурируют с белковыми частицами и вследствие повышенной плотности заряда отнимают у них гидратную воду. Лишенные гидратной оболочки белки образуют агломераты и выпадают в осадок.
Растворимость белков изменяется (снижается) и под действием органических растворителей (спирт, ацетон). В их присутствии снижается диэлетрическая постоянная водного раствора, а от этого уменьшается гидратация. Взаимодействие между белком и спиртом тем сильнее, чем в более неустойчивой форме белок присутствует в растворе. Это свойство используют для установления термостабильности молока по алкогольной пробе при выработке стерилизованных молочных продуктов.
Оптические свойства белков. Оптические свойства белковых растворов используют для быстрого определения концентрации отдельных белков или смеси белков:
- поглощение ультрафиолетового спектра или абсорбция света (спектрофотометрический метод);
- определенная величина показателя преломления света (рефрактометрический метод);
- оптическая активность белков или способность вращать плоскость поляризации (изменение удельного вращения плоскости поляризации происходит при денатурации белка, измеряя эти изменения можно следить за денатурацией белка).
Денатурация белка - это одно из наиболее существенных свойств белков. Денатурация является следствием необратимых изменений.
Денатурация – это изменение структуры белка по сравнению с его нативным состоянием. При изменении структуры (развертывании вторичной и третичной структуры) высвобождаются расположенные внутри сферических конфигураций функциональные группы. Развертывание структур происходит вследствие нарушения водородных и гидрофобных связей из-за относительно малой энергии этих связей. Первичная структура при этом не изменяется, так как пептидные связи сохраняются.
Денатурация может явиться следствием физических воздействий: высокая температура, давление, высокоэнергетическое излучение (ультрафиолетовое или ионизирующее), звуковая энергия, либо химических воздействий: органический растворитель (спирт, ацетон), раствор мочевины, химические соединения, реагирующие с функциональными группами на поверхности белка.
При денатурации связи, ранее поддерживающие структуру, высвобождаются и могут по новому ориентироваться. При этом активные функциональные группы, которые первоначально размещались внутри сферических конфигураций, могут взаимодействовать с другими молекулами белка.
Сывороточные белки денатурируют полностью при нагревании до 90оС (5 мин) или 76оС (60 мин). Фракции сывороточных белков имеют различную термоустойчивость, так β-лактоглобулин начинает денатурировать при 70оС, α-лактальбумин – 72, альбумин сыворотки крови – 64, иммуноглобулины – 60оС. Степень денатурации зависит не только от температуры, но и от продолжительности ее воздействия.
Для основных сывороточных белков - β-лактоглобулина и α-лактальбумина характерна способность части денатурированных молекул восстанавливать свою нативную структуру (после охлаждения молока). Это явление называют ренатурацией. Особенно высока способность к ренатурации у α-лактальбумина. Обратимость денатурации его (при рН свежего молока) составляет около 90%. Такую высокую степень ренатурации термически денатурованного α-лактальбумина объясняют способностью белка стабилизировать свою структуру с помощью кальция. По мнению японских ученых эта фракция белка в нативном состоянии способна связывать ионы кальция, удаление которого при нагревании сопровождается конформациоными изменениями структуры белка. Но при последующем охлаждении кальций вновь присоединяется к белку и способствует восстановлению его третичной структуры.
Обратимость денатурации β-лактоглобулина значительно ниже. После нагревания до температуры от 70 до 80оС лишь небольшая часть его молекул восстанавливает свою нативную структуру.
Вследствие конформационных изменений в сывороточных белках после тепловой обработки они могут образовывать комплексы друг с другом (β-лактоглобулин – α-лактальбумин), которые способны взаимодействовать с χ-казеином. Результатом такого взаимодействия является увеличение заряженной поверхности казеиновых мицелл и усиление их гидратационных свойств.
Нарушения структуры казеина при пастеризации молока (до 100оС) не происходит. Изменение структуры и распад казеина возможен при нагревании до 120оС в течение 5 ч. При гомогенизации происходит распад мицелл казеина на субмицеллы.
Денатурация белков не снижает их пищевой ценности, напротив, денатурированные белки легче перевариваются, так как легче атакуются протеолитическими ферментами.
Явления денатурации белков молока, вызываемые нагреванием, действием ферментов, условиями хранения, создают ряд проблем в практике молочной промышленности. При производстве отдельных продуктов (кисломолочные напитки, творог, сыры отдельных видов) наоборот, сознательно вызывают денатурацию белков (тепловыми воздействиями). Денатурация белков часто сопровождается распадом белков. Это комплексные изменения и их не всегда возможно четко разделить.
Дата добавления: 2016-01-20; просмотров: 1805;
