Электрохимия и ее использование
Электрохимия - это раздел физической химии, где разрабатывются научные основы электролиза, гальванотехники, создания химических источников тока и других процессов, связанных с протеканием электрического тока в средах, содержащих подвижные ионы.
Под электролизом понимают совокупность электрохимических окислительно-восстановительных процессов, происходящих на погруженных в электролит (проводящую жидкость) электродах под воздействием электрического тока.
Осуществляют электролиз в устройствах, называемых электролизерами (Рис. 7.7). В качестве электролитов могут выступать водные растворы солей, кислот, щелочей и другие проводящие среды.
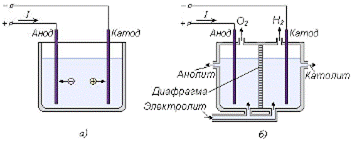
|
| Рис. 7.7 – Электролизеры: а) простейший электролизер; б) диафрагменный электролизер |
При прохождении тока через электролит (Рис. 7.7.6, а) отрицательно заряженные ионы (анионы) движутся к положительно заряженному аноду. Положительные ионы (катионы) движутся к отрицательному электроду – катоду. Анионами являются молекулы кислорода, хлора, сульфат анионы и другие (Табл. 7.3). В качестве катионов выступают ионы металлов и водорода.
| Таблица 7.3 - Электролиз некоторых веществ. | ||
| Электролит | Анион | Катион |
| Соляная кислота (HCl) Серная кислота (H2SO4) Поваренная соль (NaCl) Едкий натр (NaOH) Сульфат меди (CuSO4) | Cl2 O2 (из SO4) Cl2 O2 (из OH) O2 (из SO4) | H2 H2 Na H2 Cu |
В процессе электролиза на электродах выделяется металл и водород (на катоде), на аноде – молекулярный остаток.
Массу т выделившегося вещества можно определить согласно первому закону Фарадея:
m = k Q ; мг, (7.5)
где k – электрохимический эквивалент, мг/Кл (Табл. 7.4);
Q – переносимый заряд, Кл.
Заряд Q, необходимый для выделения 1 моля вещества, для всех электролитов одинаков. Он равен произведению постоянной Авогадро NA = 6,022045∙1023 моль-1 и элементарного электрического заряда е = 1,6021892∙10-19 Кл и называется числом Фарадея:
F = NA e = 9,648456∙104 Кл/моль. (7.6)
С помощью электролиза можно получать растворы с различными свойствами. Если электролизер оборудовать ионопроницаемой диафрагмой (Рис. 7.6, б), то с помощью электролиза можно получать растворы с различными свойствами. Вещества, выделяющиеся в анодной области, не будут проходить через диафрагму в катодную область и наоборот. Растворы этих веществ образуют анолит и католит. Например, если в качестве электролита использовать водный раствор поваренной соли, то получим католит в виде щелочного раствора (рН = 8…12), обладающий хорошими моющими свойствами, и «кислотный» анолит (рН = 2…4), который может использоваться для дезинфекции, растворения солевых отложений на стенках оборудования и для других целей.
| Таблица 7.4 - Электрохимические эквиваленты некоторых веществ | ||
| Вещество | Валентность | k, мг/Кл |
| Алюминий Водород Железо Кислород Натрий ОН-группа Хлор | 0,0932 0,01045 0,1929 0,0829 0,2383 0,1763 0,3674 |
Посредством электролиза достаточно просто осуществить электрофлотацию, позволяющую разделять жидкие неоднородные системы (мутные фруктовые соки, сточные воды и др.). Сущность этого метода состоит в разложении путем электролиза воды на водород и кислород в виде очень мелких пузырьков, осаждающихся на поверхности твердых частиц, которые будут увлекаться вверх и всплывать. При этом в основном используются пузырьки водорода, выделяющиеся на катоде, так как они обладают большей подъемной силой и их в два раза больше.
Например, при очистке виноградного сока применение электрофлотации дает высокий производственный эффект. Причем электрофлотация не влияет на содержание сахара, сухих, дубильных, зольных и красящих веществ, щелочность и рН среды. При реализации данного процесса желательно использование диафрагменного электролизера.
Очистка сточных вод протекает более благоприятно в присутствии кислорода, поэтому при электрофлотации диафрагма не используется. Толщину слоя жидкости пронизывают пузырьки водорода и кислорода, что обеспечивает определенное бактерицидное действие. Так, при электрофлотации сточных вод мясокомбината удается извлекать до 90-95% жира. Это очень высокий показатель по сравнению с другими используемыми методами.
Электрокоагуляция, как частный случай электрофлотации, позволяет эффективно осуществлять выделение из растворов каллоидных частиц и дает хорошие результаты при выделении белка из молочной сыворотки, белка картофеля из сока картофеля при производстве крахмала, при очистке сточных вод и при других процессах. В ряде случаев используются растворимые аноды из алюминия, железа. Материал анода при этом выступает в качестве коагулянта.
Дата добавления: 2016-01-18; просмотров: 1271;
