Распределение электронов в атоме по состояниям
Квантовые числа
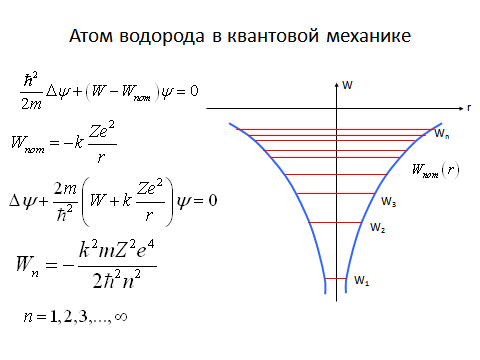
Итак, из решения уравнения Шредингера для электрона, находящегося в атоме, следует, что его энергия Wn, а значит и импульс pn и волновое число kn не могут быть любыми, они квантуются.
Поэтому и волновая функция, описывающая поведение каждого электрона, находящегося в разных состояниях, должна быть разной даже для одного электрона.
Так как электрон в атоме обладает значительными волновыми свойствами
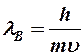 m ~ 10-30 м, u1 ~ 106 м/с.
m ~ 10-30 м, u1 ~ 106 м/с.
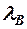 ~ 10-10 м~размер атома !
~ 10-10 м~размер атома !
поэтому его нельзя рассматривать в виде частицы, понятие «траектория движения» = «орбита электрона» неприменимы!
Зная, что квадрат модуля волновой функции определяет вероятность нахождения электрона в атоме, можно представлять электрон в виде некоторого отрицательно заряженного облака, имеющего разную форму в зависимости от его состояния.
Для описания с помощью волновой функции поведения конкретного электрона, находящегося в атоме в разных состояниях, используются квантовые числа:
1. Главное квантовое число n, которое определяет значение энергии электрона в атоме
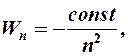 n = 1, 2, 3, …, ¥
n = 1, 2, 3, …, ¥
2. Орбитальное (азимутальное) квантовое число 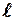 , которое определяет форму электронного облака (форму электронной орбитали).
, которое определяет форму электронного облака (форму электронной орбитали).
Электронная орбита ® электронная орбиталь !!!
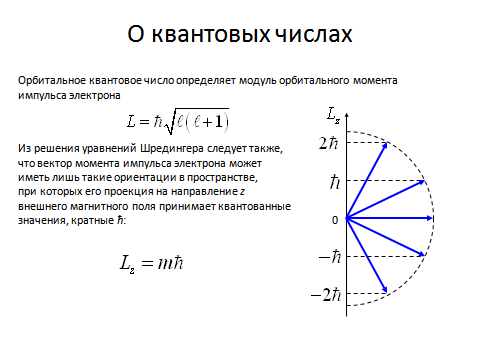
Так как электрон в атоме находится в непрерывном движении, то он обладает орбитальным моментом импульса L, который так же как и энергия, квантуется
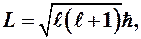 (9-1)
(9-1)
где 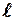 = 0, 1, 2, 3, …, n – 1.
= 0, 1, 2, 3, …, n – 1.
В спектроскопии электронным орбиталям различной формы (с разным орбитальным квантовым числом 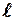 ) сопоставимы свои обозначения
) сопоставимы свои обозначения
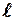 = 0, 1, 2, 3, …, n – 1
= 0, 1, 2, 3, …, n – 1
s p d f ……
3. Магнитное квантовое число m, которое характеризует ориентацию электронной орбитали в пространстве по отношению к какому-либо направлению (например, по отношению к направлению внешнего магнитного поля).
Если классическая электродинамика считала, что момент импульса электрона может быть произвольно ориентирован по отношению к любому направлению (например, к направлению внешнего магнитного поля), то квантовая механика (это следует из решения уравнения Шредингера) утверждает, что вектор момента импульса электрона может иметь только такие ориентации в пространстве, при которых его проекции на направление внешнего магнитного поля принимают квантовые значения, кратные постоянной Планка:
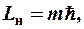 (9-2)
(9-2)
где m = 0, ±1, ±2, …, ± 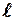 ,
,
т. е. всего 2 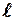 +1 значений.
+1 значений.
Хотя энергия электрона и зависит только от главного квантового числа n, но каждому собственному значению энергии Wn (кроме W1) соответствует несколько волновых функций 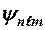 , отличающихся значением
, отличающихся значением 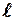 и m.
и m.
Следовательно, атом может иметь одно и то же значение энергии, находясь в нескольких различных состояниях.
Согласно квантовой механике каждому энергетическому состоянию соответствует своя волновая функция, квадрат модуля которой определяет вероятность обнаружения электрона в единице объема атома.
Вероятность обнаружения электрона в разных частях атома различна. Электрон при своем движении как бы «размазан» по всему объему, образуя электронное облако, плотность которого характеризует вероятность нахождения электрона в различных точках объема атома.
Квантовые числа n и 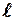 характеризуют размер и форму электронного облака, а квантовое число m характеризует ориентацию электронного облака в пространстве.
характеризуют размер и форму электронного облака, а квантовое число m характеризует ориентацию электронного облака в пространстве.
Квантовые числа n, 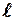 , и m позволяют точнее описать спектр испускания (поглощения) атома (в частности, атома водорода, описанный в теории Бора).
, и m позволяют точнее описать спектр испускания (поглощения) атома (в частности, атома водорода, описанный в теории Бора).

В квантовой механике вводятся правила отбора,ограничивающие число возможных переходов электронов в атоме, связанных с испусканием и поглощением света.
Теоретически доказано и экспериментально подтверждено, для электрона в атоме могут осуществляться только такие переходы, для которых:
1) орбитальное квантовое число 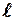 изменяется только на единицу
изменяется только на единицу
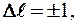
2) изменение магнитного квантового числа m удовлетворяет условию
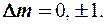
С учетом этого спектральные серии линий излучения атома водорода должны соответствовать переходам:
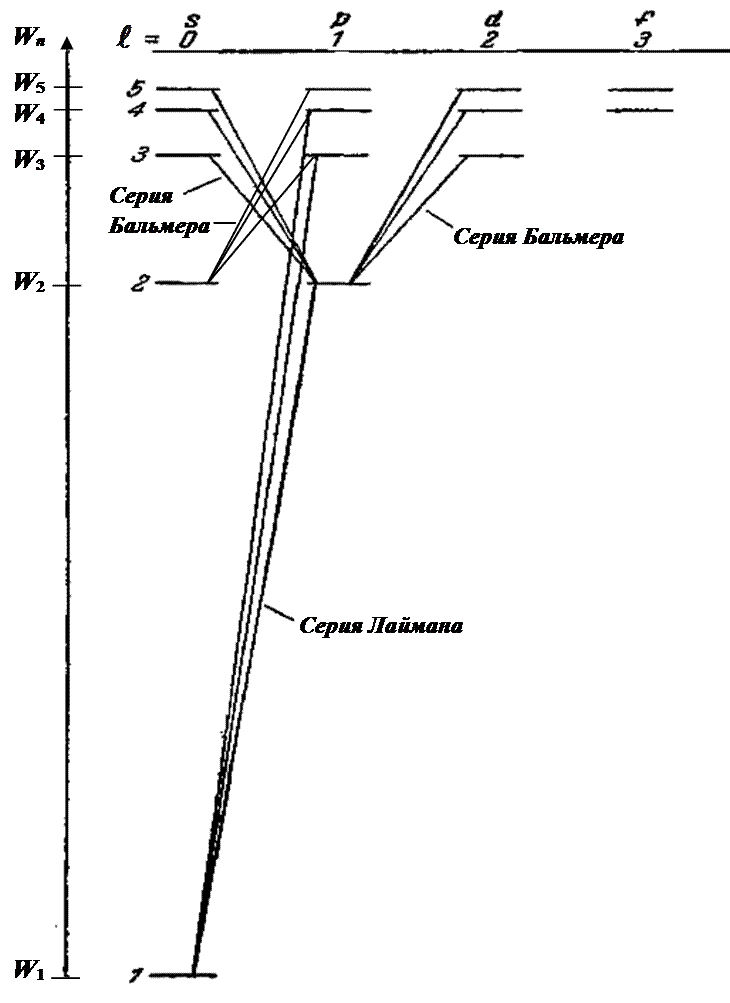

4. Согласно законам классической механики электрон, двигаясь в атоме, обладает не только орбитальным моментом импульса 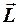 , но и магнитным моментом
, но и магнитным моментом 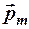 , направленным
, направленным 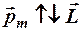 .
.
Отношение магнитного момента электрона в атоме 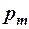 к орбитальному моменту импульса L называется гиромагнитным отношением
к орбитальному моменту импульса L называется гиромагнитным отношением
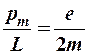 (9-3)
(9-3)
где e – электрический заряд электрона,
m – масса электрона.
Но эксперименты, проведенные Эйнштейном и де Гаазом, по измерению гиромагнитного отношения дали результат вдвое больший:
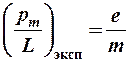 (9-4)
(9-4)
? ? ?
Более того, Штерн и Герлах, проведя прямые измерения магнитных моментов, обнаружили, что узкий пучок атомов водорода, заведомо находящийся в основном состоянии 1s, в неоднородном магнитном поле расщепляется на два пучка.
В этом состоянии 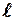 = 0, поэтому момент импульса, а значит и магнитный момент такого электрона (атома водорода) равен нулю и магнитное поле не должно оказывать влияние на движение атомов водорода в основном состоянии, т.е. расщепления быть не должно.
= 0, поэтому момент импульса, а значит и магнитный момент такого электрона (атома водорода) равен нулю и магнитное поле не должно оказывать влияние на движение атомов водорода в основном состоянии, т.е. расщепления быть не должно.
Однако эксперимент показал, что в s-состоянии даже в отсутствие внешнего магнитного поля, существует расщепление.

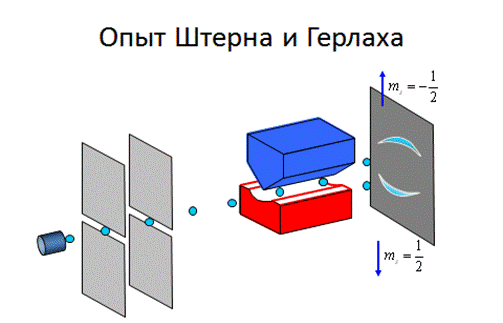
Для объяснения этого факта, американские физики Уленбек и Гауд-смит предположили, что электрон обладает кроме орбитальных момента импульса и магнитного момента, еще и собственным неуничтожимым механическим моментом импульса – спином Lsи собственным магнитным моментом 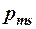 , которые тоже квантуются:
, которые тоже квантуются:
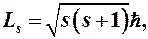 (9-5)
(9-5)
где s – спиновое квантовое число (для электрона s = 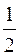 ).
).
Проекция 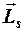 на направление внешнего магнитного поля удовлетворяет условию:
на направление внешнего магнитного поля удовлетворяет условию:

где ms – магнитное спиновое квантовое число (для электрона ms может принимать только два значения 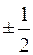 ).
).


Т.о. для полного описания состояния электрона в атоме необходимо наряду с главным, орбитальным и магнитным квантовыми числами задавать еще и магнитное спиновое квантовое число.
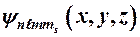 .
.

Распределение электронов в атоме по состояниям
Распределение электронов в любом атоме по состояниям подчиняется принципу минимума энергии:
- наиболее выгодное энергетическое состояние для электрона в атоме – это состояние с минимальной энергией.
Далее электроны занимают свободные состояния в соответствии с набором четырех квантовых чисел n, 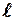 , m и ms.
, m и ms.
Кроме того, распределение электронов в атоме подчиняется принципу запрета Паули:
- в одном и том же атоме не может быть даже двух электронов с одинаковым набором всех четырех квантовых чисел.
Таким образом, принцип Паули утверждает, что два электрона, связанные в одном и том же атоме, различаются значениями по крайней мере одного квантового числа.
Максимальное количество электронов, находящихся в состояниях, определяемых данным главным квантовым числом, равно
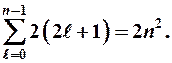 (9-6)
(9-6)
Кроме того при заполнении различных состояний электронами руководствуются правилом Хунда (Гунда):
 ¯ ¯
¯ ¯
нет да



Пример:атом натрия 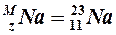
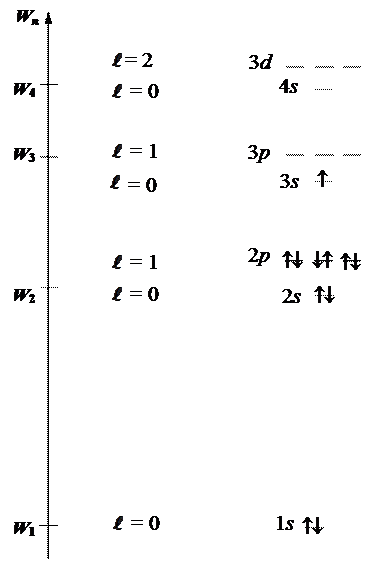 |
ряд Клечковского
 |
Na: 1s22s22p63s1
Совокупность электронов в многоэлектронных атомах, имеющих одно и то же главное квантовое число n, называется электронной оболочкой (K, L, M, N, …).
В каждой из оболочек электроны распределяются по подоболочкам, соответствующим данному  .
.
Таблица
| Главное квантовое число n | ||||||
| Символ оболочки | K | L | M | |||
| Максимальное число электронов в оболочке | ||||||
Орбитальное квантовое число 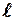
| ||||||
| Символ подоболочки | 1s | 2s | 2p | 3s | 3p | 3d |
| Максимальное число электронов в подоболочке |
| <== предыдущая лекция | | | следующая лекция ==> |
| Энергетические уровни | | | РАСЧЁТ ЗАЩИТНОГО КЛЮЧА В НОМЕРЕ ЛИЦЕВОГО СЧЁТА |
Дата добавления: 2016-01-18; просмотров: 3726;
