Аргентометрия және тиоцианатометрия титрлеу әдістері
Жоспар:
1.Аргентометрия.
2.Тиоцианатометриялық титрлеу.
3.Меркурометриялық титрлеу.
Аргентометрияда негізінен галогенидтерді анықтау үшін күміс нитратының ерітіндісін қолданады. Әдістің әр түрі бар: Мор әдісі бойынша хлорид және бромид иондарын олардың тұздарынан анықтау; Фаянс әдісі бойынша бромидтер, иодидтер және родонидтерді адсорбциялық флуоресцеин индикаторымен анықтау; Фольгард әдісі бойынша бромидтер, иодидтерді анықтау.
Мордың әдісі бойыншатитрлеудің соңындағы нүктеде күміс хроматының қызыл кірпіш тұнбасының түзілуіне әдістің идеясы негізделеді. Күміс хроматы тұнбасының мұндай концентрациясын көзбен көруге болмайды. Күміс хроматы тұнбасын көзбен көру үшін анализделетін ерітіндісіне AgNO3 ерітіндісінің бір тамшысын артық тамызып титрлесе болғаны, индикатор түсін байқай аламыз.
Бұл әдісте индикатор калий хроматы болып табылады. Хроматпен титрлеу бейтарап немесе әлсіз сілтілікортада, ерітіндінің рН-ы 6,5-10,5 аралығында болғанда жүргізіледі. Сілтілік ортада гидро-хромат-ионмен тепе-теңдікте болатын хромат-иондары басымырақ, алдыңғысының түзілуі қышқылдау аймақта мына теңдеуге сәйкес келеді:
CrO4 + H ↔ HCrO4
рН<6,5 болғанда индикатордың сезгіштігі төмендейді, ал рН>10,5 болса, тұнбаға түсіп, анализ нәтижелерін дұрыс көрсетпейтін күміс гидрооксидтері және оксидтері түзілуі мүмкін Бұрын аталғандай Мор әдісімен хлоридтер және бромидтер анықталады.
Фольгардтың әдісі бойыншакүмістің тиоцианат-ионымен әрекеттесу реакциясын есепке алып, галогенид-иондарды анықтау үшін кері титрлеу әдісін қолданады. Галогеидтердің анализденетін ерітіндісіне күміс нитратының титрленген ерітіндісінің артық мөлшеріне қосады, тұнбаға түспеген күміс иондарын темір (III) тиоцианат ионымен титрлейміз. Индикатор – темір (III) тиоцианат комплексі.
Фольгард әдісі күміс ионымен нашар еритін қосылыстар түзетін мысалы оксолаттар, фосфаттар және басқалар сияқты аниондарды титрлеуге мүмкіндік туғызады. Титрлеуді қышқыл ортада өткізеді, бұл әдістің елеулі құндылығы болып табылады.
Фаянстың әдісі бойынша адсорбциялық индикатор қосылыстар қолданылады, олар тұнбаға адсорбцияланғанда өзінің түсін өзгертеді, ең бірінші түзілген тұнба бетіне онымен біраттас иондар адсорбцияланады. Бромидті күміс нитратымен титрлегенде AgBr тұнбасының бетіне бромид-иондары эквиваленттік нүктесіне дейін көбірек адсорбцияланады, ал артық теріс зарядты бейтараптау үшін тұнба бөлшектеріне ерітіндіден оң зарядталған иондар тартылады. Хлоридті титрлеу үшін жиі қолданылатын адсорбциялық индикатор флуоресцеин болып табылады. Бұл индикатормен титрлеуді рН=7-10 болғанда жүргізеді, себебі ол әлсіз қышқыл болып табылады.
Бақылау сұрақтары:
1. Аргентометрияның басқа әдістермен ұқсастығы және айырмашылығы қандай ?
2.Фаянстың әдісі мен Фольгардтың әдісін қандай жағдайларда қолданады ?
3.Адсорбциялық индикаторлардың қандай кемшіліктері бар ?
4.Калийдің хроматының индикатор ретінде кемшілігі қандай ?
№ 14-15-ші дәріс
Комплексонометрия
Дәрістің жоспары:
1. Комплексиметриялық титрлеу әдістің негізі.
2. Комплексиметриялық индикаторлар және орын алатын қателіктер.
3.Комплексиметрияның қолданылуы. Судың жалпы кермектілігін анықтау.
Комплексон деп аталатын кейбір органикалық реактивтермен комплекстік қосылыстар түзетін иондарды анықтау реакцияларына комплексонометрия негізделген. Мұнда өте берік, суда жақсы еритін комплекстік қосылыстар түзіледі. Әдіс тездігімен және жоғарғы дәлдігімен ерекшеленеді.
Комплексондар аминополикарбон қышқылдарының туындысы болып табылады.
Комплексонометриялық титрлеу ертеректен белгілі. Алғашқы жұмыстар иодид иондарын анықтауға жатады.
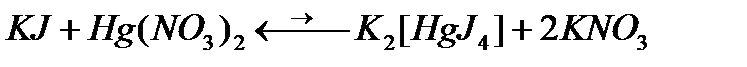
1851 жылы Либих цианидтерді күміс нитраты ерітіндісімен комплексонометриялық анықталу туралы жазды:
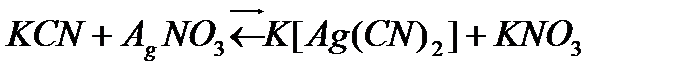
Бейорганикалық титранттар қазіргі уақытта шектеулі қолданылады. Оларды ең кең тарағаны хлоридтерді, бромидтерді, роданидтерді, цианидтерді және тиомочевинаны меркуриметриялық титрлеу әдісі.
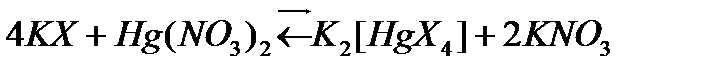
Органикалық тиранттар айтарлықтай көп таралған. Соңғы уақытта тиолдар, купферон, дитизон және басқалар қолданылып жүр.
Олардың комплекстерге қарағанда артықшылығы арнайылығында. Органикалық комплекс түзушілерді қолданылатын титриметриялық әдістерде эквиваленттік нүктесін металлохромдық индикатормен анықтайды.
Комплексонометрия реакцияларына қойылатын жалпы талаптар барлық титриметриялық әдістегілерге ұқсас: - олар тез, соңына дейін, қосымша процестерсіз және т.с.с. өтуі керек.
Комплесонометриялық әдістің сұрыпталуы әдетте үлкен емес және қандай донорлық атомдар катионмен әректесуде қатысатынына байланысты. Иодидтер кейбір элементтермен ғана 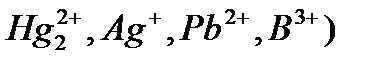 тұнба және комплекстер түзетін болғандықтан, калий иодидімен титрлеу жоғарғы сұрыпталуға алып келеді. Аммиак және полиаминдердің де, әсіресе, комплексондарға қарағанда сұрыпталуы бойынша ерекшелігі үлкен, себебі ол элементтердің аз санымен тұрақты комплестер түзеді.
тұнба және комплекстер түзетін болғандықтан, калий иодидімен титрлеу жоғарғы сұрыпталуға алып келеді. Аммиак және полиаминдердің де, әсіресе, комплексондарға қарағанда сұрыпталуы бойынша ерекшелігі үлкен, себебі ол элементтердің аз санымен тұрақты комплестер түзеді.
ЭДТА қолданған алғашқы титриметриялық методикаларда кәдімгі қышқылды-негіздік индикаторлар пайдаланылған, себебі ЭДТА-ның артық мөлшері металл тұзының бейтарап ерітіндісіне қосылады да реакция нәтижесінде тиісті мөлшерде бөлініп шыққан сутек иондары титрленген. Бұл әдіс кейбір жағдайларда қазір де қолданылады.
Комплексонометрияның қарқынды дамуы металлохромды индикаторлардың ашылуымен байланысты. Бұл заттар металл иондарымен әрекеттескенде боялған қосылыстар түзеді, бірақ комплексонаттарға қарағанда беріктігі нашарлау. Металл иондармен комплекс түзетін индикаторларды бос иондардан немесе индикатор молекуларынан түсі бойынша ажыратады.
Бұл индикатордың алғашқылары мурексид (МУР) болды – пурпур қышқылының аммоний тұзы. Оның қолданылуы Шверценбахтың лабораториядағы кездейсоқ зерттеуіне негізделген.
Кальций тұздарымен сарғыш-қызыл түсті кальций пурпуреаты түзіледі. Пурпур қышқылы үш негізді. Оның константалары: рK=0; pK2=9,2 және pK3=10,9. 0,1 M пурпуреат аммонийдің сулы ерітінділері 12-15 күнде ыдырайды. Индикатордың ерітінділерін анализдің алдында ғана даярлайды. Мурексид өлшендісін өлшеу ыңғайлы болу үшін оны натрий хлоридімен араластырады, анализденетін ерітіндіде оның концентрацисы жоғары болмау қажет, себебі бұл жағдайда индикатордың өту интервалының анықтығы нашарлайды. Мурексид ерітіндісіндегі тепе-теңдікті сызба нұсқада жазамыз.
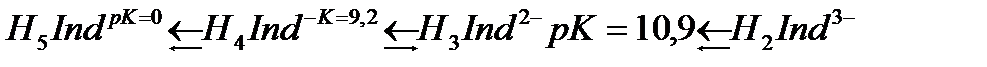
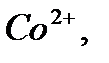
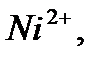
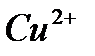 сары түсті комплекстер түзеді және оларды индикатор түсі сарыдан көгілдір күлгінге өткенше аммиакты ортада комплексонмен титрлейді. Реакцияны жылдамдату үшін титрлеуді жоғары температурада жүргізеді. Мурексидпен комплекстердің құрамы ерітіндінің рН-ына байланысты. Мурексидпен комплекстердің құрамы ерітіндінің рН-ына байланысты. Мысалы, мырыш әлсіз сілтілік ортада 1:1 комплексін, ал сілтілік ортада 1:2 түзеді.
сары түсті комплекстер түзеді және оларды индикатор түсі сарыдан көгілдір күлгінге өткенше аммиакты ортада комплексонмен титрлейді. Реакцияны жылдамдату үшін титрлеуді жоғары температурада жүргізеді. Мурексидпен комплекстердің құрамы ерітіндінің рН-ына байланысты. Мурексидпен комплекстердің құрамы ерітіндінің рН-ына байланысты. Мысалы, мырыш әлсіз сілтілік ортада 1:1 комплексін, ал сілтілік ортада 1:2 түзеді.
Комплексонометрияда эриохром қара Т-ны кеңінен қолданады, бұл азобояғыш және оның молекуласында хелат түзуші топтар бар:
Сульфаттың протоны ерітіндіде толық диссоциацияланады, ОН—тобынан протондардың әрі қарай үзілуі, индикатор түсінің өзгеруіне алып келеді, ол ерітіндінің рН-на тәуелді:
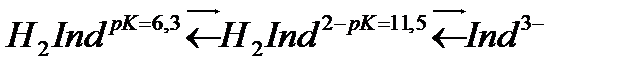
Аммиакты ерітіндіде басым анион металл иондарымен әрекеттеседі де қызыл немесе күлгін түсті бояулы қосылыс түзеді.
Комплексонометриялық титрлеу үшін қышқыл хром көк Т индикаторы ұсынылған. Олар кальций, мырыш, қорғасын, марганец және магний иондарымен қызыл түсті комплекс ішілік қосылыстар түзеді және оларды титриметриялық анықтау үшін 1 %-дық спирттік ерітінді түрінде қолданады (рН 12). Қышқыл ортада олар сарғыш қызыл.
Комплексонометриялық титрлеудің соңғы нүктесін индикатордың жалпы түрі төмендегідей өрнектелетін тиісті комплекс түзуші константасы бар комплекс түзеді:
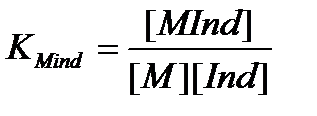
Түсінің өзгеруі шамамен [MInd]=[Ind] болады да, ал өту нүктесі рМТ мына арақатынаспен анықталады:
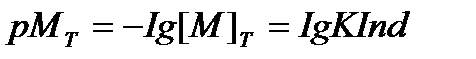
Көп сатылы комплекс түзілуі процесі үшін шартты константаны а-ның комплекстенген функциясы арқылы шығаруға болады:
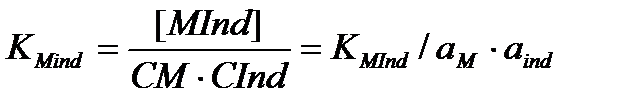
Онда 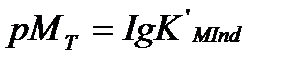
Индикатордың металмен комплекстерінің беріктігі ерітіндінің рН-на тәуелді. Титрлеу процесінде металдың индикатормен комплексі бұзылып, титрантпенен беріктеу комплекс түзіледі, титрлеудің соңғы нүктесіне ерітінді түсі өзгереді.
Қателіктер өте аз болуы үшін, төмендегі талаптар орындалуы қажет: металдың индикатормен комплексінің шарты тұрақтылық комплексінің мәні 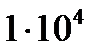 көп болуы қажет; КМҮ және КMind тұрақтылық константалары бірнеше ретке ерекшеленуі керек; индикаторды ион концентрациясын 1 %-тен артық емес мөлшерде қосқанда ерітіндінің бояуының қанықтығын қамтамасыз етілуі керек; титрленгенде ерітіндіні сұйылту тек қана рМТ>рМэкв мақсатқа сай орындалуы керек.
көп болуы қажет; КМҮ және КMind тұрақтылық константалары бірнеше ретке ерекшеленуі керек; индикаторды ион концентрациясын 1 %-тен артық емес мөлшерде қосқанда ерітіндінің бояуының қанықтығын қамтамасыз етілуі керек; титрленгенде ерітіндіні сұйылту тек қана рМТ>рМэкв мақсатқа сай орындалуы керек.
Комплексонометрияны қолдану. Судың жалпы кермектігін анықтау. Комплексонометрияда қолданылатын ерітінділер – ЭДТА-ның 0,1 М; 0,05 М; 0,01 М ерітінділері; магнийдің сульфатының 0,1 М; 0,05 М; 0,01 М ерітінділері; мырыштың сульфатының 0,1 М; 0,05 М; 0,01 М ерітінділері. ЭДТА ерітіндісін «Трилон Б» химиялық таза ұнтағынан нақты салмақ бойынша дистилденген суда дайындайды. Дистилденген судың құрамында кальцийдің және магнийдің тұздарының қсопалары болмауы керек. Еріткіш ретінде дистилденген судың жарамдылығын қышқылдық хромдық қара арнайы индикатордың көмегімен анықтайды. Ол үшін 100 см3 суға 5 см3 аммиактық буферлік ерітінді және 0,1 г индикаторлық қоспаны қосады. Индикаторлық қоспаның құрамы индикатор:натрийдің хлориді – 1:500. Ерітіндінің түсі күлгін, 0,05 М ЭДТА ерітіндісінен 1-2 тамшы қосқанда көк түске өтеді. Ал 0,1 н. мырыштың сульфатының ерітіндісінен 1-2 тамшы қосқанда қайтадан күлгін түске өтеді. Егер осы сынаққа су жауап берсе, онда ол жарамды болып саналады. Басқа жағдайда жарамсыз болып табылған дистилденген суды КУ-2 катиониті бар бағаналардан өткізіп тазалайды.
ЭДТА-ның титрін өлшенген салмақ бойынша немесе стандарттар – мырыштың сульфаты, магнийдің сульфаты, кальцийдің карбонаты бойынша белгілейді.
Титрлеуді тікелей, кері және ығыстыру тәсілдері бойынша орындауға болады.
Техникалық, агрохимиялық анализ тәжірибесінде, тамақ өнеркәсібінде және халық шаруашылығының басқа салаларына су кермектігін комплексонометриялық анықтауды жиі қолданады, оны 1 л судағы қальций және магнийдің мг-эвиваленттерінің қосындысы санымен сипаттайды.
Анализді жасау үшін зерттелетін суды аммоний буферлік қоспамен рН-10 болғанша сілтілендіреміз. Индикатор ретінде арнайы хромоген қара ЕТ-00 ерітіндісін пайдаланады, ол Са2+ және Мg2+ иондарымен шарап қызыл түсті ерімтал комплекстер түзеді:
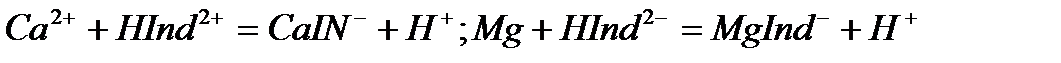
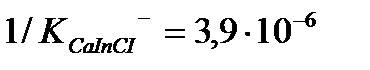
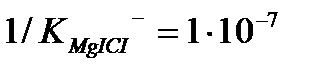
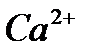 және
және 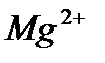 ЭДТА-мен тұрақсыздық константалары едәуір кіші
ЭДТА-мен тұрақсыздық константалары едәуір кіші 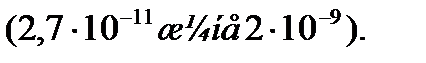 Сондықтан ЭДТА ерітіндісімен титрленгенде, ол тиісті комплекстерден индикаторды ысырып шығарып, одан да берік комплекстер түзеді. Реакция өтеді, босап шыққан индикатордың түсі көк.
Сондықтан ЭДТА ерітіндісімен титрленгенде, ол тиісті комплекстерден индикаторды ысырып шығарып, одан да берік комплекстер түзеді. Реакция өтеді, босап шыққан индикатордың түсі көк.
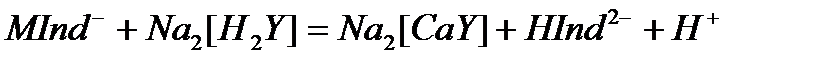
Сонымен эквиваленттік нүктесінде ерітіндінің шарап қызыл түсі көкке ауысады.
Табиғи суда титрлеу үшін, әдетте, 0,05 н ЭДТА жұмысшы ерітіндісін пайдаланады.
Ерітіндінің жалпы кермектігін мына формула бойынша есептейді:
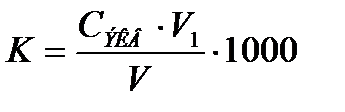
Мұндағы 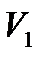 және
және 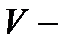 титрлеуге кеткен комплексон көлемі және анықтауға алынған су көлемі, мл.
титрлеуге кеткен комплексон көлемі және анықтауға алынған су көлемі, мл.
Бақылау сұрақтары:
1.Комплексиметриялық титрлеу мен комплексонометрияның арасындағы ұқсастық қандай ?
2.Аминокарбон қышқылдарының кешен түзу қабілеті қандай функционалдық топтарға байланысты ?
3.Судың кермектілігін басқа қандай әдістермен анықтауға болады ?
4.Анализді жасау үшін зерттелетін суды аммоний буферлік қоспамен сілтілендіреді. Не үшін ?
№ 16-17-ші дәріс
Дата добавления: 2015-12-26; просмотров: 9266;
