Стандартная теплота образования.
Из закона сохранения энергии следует, что, когда вещество образуется из атомов и (или) более простых веществ, внутренняя энергия или энтальпия системы меняется на определенную величину, называемую теплотой образования данного вещества. Теплота образования может быть определена различными способами, в том числе прямыми калориметрическими измерениями и путем косвенного расчета (на основе закона Гесса) из теплоты реакции, в которой участвует данное вещество. При проведении расчетов пользуются стандартными (при p = 1 атм и T = 298 K) теплотами образования веществ, входящих в уравнение реакции. Например, стандартную теплоту (энтальпию) образования метана можно вычислить с помощью термохимического уравнения

Хотя эта реакция практически неосуществима при 25 С, стандартная теплота образования метана косвенно рассчитывается по измеренным теплотам сгорания метана, водорода и графита. На основе закона Гесса устанавливается, что теплота реакции равна разности между теплотами сгорания веществ, указанных в левой части уравнения, и теплотами сгорания веществ, указанных в правой части уравнения реакции (взятых с соответствующими знаками и стехиометрическими коэффициентами).
Помимо использования термохимических данных для решения проблем практического использования тепловой энергии, они широко применяются при теоретической оценке энергий химических связей.
Тепловой эффект реакции зависит от природы и состояния исходных веществ и конечных продуктов, но не зависит от пути реакции.
Закон лежит в основе термохимических расчетов. Рассмотрим реакцию сгорания метана:
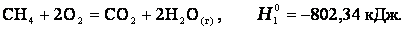
Эту же реакцию можно провести через стадию образования СО:
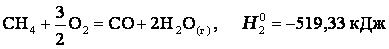
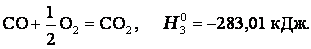
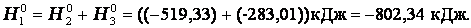
Итак, видно, тепловой эффект реакции, протекающей по двум путям, одинаков.
При термохимических расчетах для определения тепловых эффектов применяют следствия из закона Гесса.
8. Второе начало термодинамики. Энтропия.
Состояние некоторого количества вещества можно охарактеризовать, указав, например, температуру, давление – это характеристики макросостояния или указать мгновенные характеристики каждой частицы вещества – ее положение в пространстве (xi, yi, zi) и скорости перемещения по всем направлениям (vx, vy, vz) – это характеристики микросостояния вещества. Так как вещество состоит из огромного числа частиц, то данному макросостоянию отвечает огромное число микросостояний.Число микросостояний, которое соответствует данному макросостоянию вещества, называется термодинамической вероятностью состояния системы – W.
Величина W есть число различных способов, посредством которых реализуется данное состояние вещества. Макросостояние тем вероятнее, чем большим числом микросостояний оно осуществляется. Так для системы из 10 молекул W близко к 10000. Оказалось удобнее и проще характеризовать состояние системы не самой вероятностью осуществления данного макросостояния, а величиной, пропорциональной ее логарифму.
Эта величина называется энтропией и обозначается буквой S.
Дата добавления: 2016-01-16; просмотров: 1727;
