Как показано Больцманом,
· 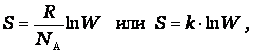
S – характеризует состояния системы и возможные изменения состояний, поэтому является функцией термодинамического состояния. Каждому состоянию системы соответствует определенное значение энтропии. Следовательно, вероятность различных состояний системы (газовое, жидкое, твердое) можно количественно выразить значением энтропии. Абсолютные значения энтропии можно определить экспериментально для простых и сложных веществ или взять из справочника термодинамических величин.
Величину S можно рассматривать как меру неупорядоченности состояния системы, то есть как количественную меру беспорядка.
2 закон термодинамики
В изолированных системах самопроизвольно протекают только те процессы, которые сопровождаются ростом энтропии системы.
В справочниках приводится, так называемая, стандартная энтропия 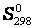 вещества, находящегося в стандартном состоянии при температуре 298,15 К. Т.к. энтропия является функцией состояния системы, то для реакции, протекающей в стандартных условиях,
вещества, находящегося в стандартном состоянии при температуре 298,15 К. Т.к. энтропия является функцией состояния системы, то для реакции, протекающей в стандартных условиях,
bB + dD = lL + mM изменение энтропии (энтропия реакции) можно рассчитать как разницу между суммарной энтропией продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов в соответствии с уравнением
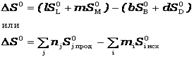 ,
,
где nj, mi – коэффициенты уравнения реакции для продуктов и исходных веществ; 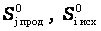 - стандартные энтропиипродуктов реакции и исходных веществ, соответственно.
- стандартные энтропиипродуктов реакции и исходных веществ, соответственно.
Энтропия растет (ΔS > 0) в процессах, связанных с повышением температуры, при плавлении вещества, при испарении, при расширении системы, растворении. В этих случаях увеличение числа частиц и энергии теплового движения увеличивает беспорядок и, следовательно, увеличивается энтропия, и наоборот – охлаждение, конденсация, кристаллизация, реакции с уменьшением объема – сопровождаются уменьшением энтропии (ΔS < 0). "Носителями" энтропии являются газы, обладающие высокими значениям.
9.Стандартные энтропии. Энергия Гиббса.
Если процесс протекает самопроизвольно, то внутренняя энергия (энтальпия) должны уменьшаться, а энтропия увеличиваться. Для сравнения этих величин их надо выразить в одних единицах, а для этого ΔS умножить на T. В этом случае имеем ΔН – энтальпийный фактор и ТΔS -энтропийный фактор.
В ходе реакции частицы стремятся к объединению, что ведет к уменьшению энтальпии (ΔН < 0), с другой стороны – должна возрастать энтропия, т.е. увеличиваться число частиц в системе (ТΔS > 0). "Движущая сила" реакции определяется разностью между этими величинами и обозначается ΔG.
ΔGp,T = ΔH – TΔS
и называется изменением энергии Гиббса (изобарно-изотермический потенциал).
Энергия Гиббса - это часть энергетического эффекта реакции, которую можно превратить в работу, поэтому ее называют свободной энергией. Это тоже термодинамическая функция состояния и, следовательно, для реакции
bB + dD =lL + mM,
энергию Гиббса химической реакции можно рассчитать как сумму энергий Гиббса образования продуктов реакции за вычетом энергий Гиббса образования исходных веществ с учетом стехиометрических коэффициентов по формуле:
ΔG = lΔfGL + mΔfGM – dΔfGD – bΔfGB.
где ΔfG –энергия Гиббса образования веществ.
Энергия Гиббса образования веществ это изменение энергии Гиббса системы при образовании 1 моль вещества из простых веществ, устойчивых при 298 К.
Энергия Гиббса образования простых веществ ΔfG принимается равной нулю. Если образующееся вещество и исходные простые вещества находятся в стандартных состояниях, то энергия Гиббса образования называется стандартной энергией Гиббса образования вещества ΔfG0. Ее значения приводятся в справочниках.
Полученное значение ΔG является критерием самопроизвольного течения реакции в прямом направлении, если ΔG < 0. Химическая реакция не может протекать самопроизвольно в прямом направлении, если энергия Гиббса системы возрастает, т.е. ΔG > 0. Если ΔG = 0, то реакция может протекать как в прямом, так и в обратном направлениях, т.е. реакция обратима.
Направление химических реакций зависит от их характера. Так, условие ΔG < 0 соблюдается при любой температуре для экзотермических реакций (ΔН < 0), у которых в ходе реакции возрастает число молей газообразных веществ, и, следовательно, энтропия (ΔS > 0). У таких реакций обе движущие силы (ΔН) и (ТΔS) направлены в сторону протекания прямой реакции и ΔG < 0 при любых температурах. Такие реакции являются необратимыми.
Дата добавления: 2016-01-16; просмотров: 1084;
