КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ. КОМПЛЕКСОНОМЕТРИЯ
Наиболее обширный и разнообразный класс неорганических веществ представляют комплексные, или координационные, соединения. Комплексным соединением называется соединение высшего порядка, в узлах кристаллической решетки которого находятся сложные частицы, построенные за счет координации одним атомом (ионом) электронейтральных молекул или противоположно заряженных ионов, и способные к самостоятельному существованию при переходе вещества в расплавленное или растворенное состояние. В координационном соединении различают внутреннюю и внешнюю сферы. Внутренняя сфера включает центральный атом – комплексообразователь – и координирующиеся вокруг него ионы и молекулы, называемыелигандами. Внутреннюю сферу комплекса при написании формулы заключают в квадратные скобки. Как правило, комплексообразователями являются катионы металлов, особенно переходных. Из неметаллов центральным атомом служат чаще всего B, P, Si, As. Лиганды представляют собой анионы или молекулы неорганической или органической природы. Комплексообразователь – обычно акцептор, а лиганды – доноры электронных пар, и при образовании комплекса между ними возникает связь по донорно-акцепторному механизму.
Число лигандов, координированных центральным атомом, - координационное число (К. Ч.) – обычно превышает его степень окисления. Наиболее часто встречаются комплексы с К. Ч. = 6, 4 или 2. Число координационных мест, которые занимает лигандво внутренней сфере, называется емкостью лиганда ( или дентатностью ). Например, в комплексном ионе [Co(NH3)4CO3]+ координационное число равно 6, емкость лиганда NH3 равна 1, а CO3 2- - 2. В комплексном ионе [Co(NH3)5CO3]+ К. Ч. = 6, емкость лигандов NH3 и CO3 2- равна 1.
Комплексное соединение общего вида [MLn]Xm диссоциирует следующим образом:
[MLn]Xm ® [MLn] m+ + m X -.
Сам комплексный ион также способен диссоциировать, но уже как слабый электролит. Комплекс под действием растворителя последовательно теряет лиганды (диссоциация протекает ступенчато), и в конечном итоге этот npoцecc можно выразить следующим образом:
[MLn] m+ « M m+ + n L.
Количественно это равновесие характеризуется общей константой нестойкости комплекса:
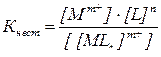 .
.
Чем больше Кнест, тем менее устойчив комплексный ион. Для некоторых соединений (двойные соли) константа нестойкости настолько велика, что они в растворе распадаются на составляющие простые ионы.
Дата добавления: 2016-01-09; просмотров: 1337;
