Примеры решения задач. Рассчитайте температурный коэффициент скорости реакции, зная, что с повышением температуры на 70 °С скорость возрастает в 128 раз.
Пример 1.
Рассчитайте температурный коэффициент скорости реакции, зная, что с повышением температуры на 70 °С скорость возрастает в 128 раз.
Решение:
Для расчета используем правило Вант-Гоффа:
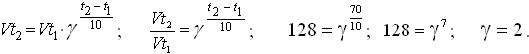
Ответ: 2
Пример 2.
При какой температуре закончится некоторая реакция за 0,5 мин, если при 70°С она заканчивается за 40 мин? Температурный коэффициент реакции равен 2,3.
Решение:
Для расчета используем правило Вант-Гоффа.Находим t2:
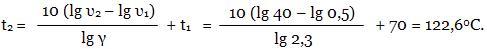
Ответ: 122,6 0С
Пример 3.
Во сколько раз изменится скорость прямой реакции N2(г)+3Н2(г)=NH3(г), если давление в системе увеличить в 2 раза?
Решение:
Увеличение давления в системе в 2 раза равносильно уменьшению объема системы в 2 раза. При этом концентрации реагирующих веществ возрастут в 2 раза. Согласно закону действия масс, начальная скорость реакции равна Vн = k·[N2]·[H2]3.
После увеличения давления в 2 раза концентрации азота и водорода увеличатся в 2 раза, и скорость реакции станет равна Vк = k·2[N2]·23[H2]3 = k·32[N2]·[H2]3. Отношение Vк/Vн показывает, как изменится скорость реакции после изменения давления. Следовательно, Vк/Vн = k·32[N2]·[H2]3/(k·[N2]·[H2]3) = 32.
Ответ: скорость реакции увеличится в 32 раза.
Пример 4.
Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению РС15(г) ↔ РС13(г) + С12(г) ; ∆Н = +92,59 кДж. Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции — разложения РС15?
Решение:
Смещением или сдвигом химического равновесия называют изменение равновесных концентраций реагирующих веществ в результате изменения одного из условий реакции. Направление, в котором сместилось равновесие, определяется по принципу Ле Шателье: а) так как реакция разложения РС15 эндотермическая ( 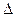 H > 0), то для смещения равновесия в сторону прямой реакции нужно повысить температуру: б) так как в данной системе разложение РС15 ведет к увеличению объема (из одной молекулы газа образуются две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление; в) смещения равновесия в указанном направлении можно достигнуть как увеличением концентрации РС15, так и уменьшением концентрации РС13 или Сl2.
H > 0), то для смещения равновесия в сторону прямой реакции нужно повысить температуру: б) так как в данной системе разложение РС15 ведет к увеличению объема (из одной молекулы газа образуются две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление; в) смещения равновесия в указанном направлении можно достигнуть как увеличением концентрации РС15, так и уменьшением концентрации РС13 или Сl2.
Дата добавления: 2016-01-09; просмотров: 15026;
