Примеры решения задач. Исследовалась кинетика процесса разложения N2O на золотом катализаторе при 900 °С
Пример1.
Исследовалась кинетика процесса разложения N2O на золотом катализаторе при 900 °С. Получены следующие данные:
р 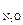 ·10–5, Н/м2 ·10–5, Н/м2
| 0,267 | 0,181 | 0,093 | 0,059 |
| T,с |
Известно, что N2O слабо сорбируется на Au, а продукты разложения не сорбируются совсем. Нужно рассчитать константу скорости данного процесса.
Решение.
Скорость процесса зависит от степени заполнения катализатора сорбентом:
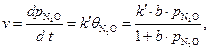 где b – адсорбционная константа Лэнгмюра.
где b – адсорбционная константа Лэнгмюра.
Для слабой адсорбции исходного вещества (b<< 1 по условию) скорость процесса будет пропорциональна 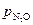 :
:
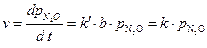 , где k = k’·b.
, где k = k’·b.
То есть данная каталитическая реакция является реакцией первого порядка, для которой константа скорости равна:

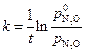 . Подсчитаем значения констант в различные моменты времени протекания реакции.
. Подсчитаем значения констант в различные моменты времени протекания реакции.
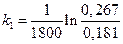 =2,16·10-4с-1;
=2,16·10-4с-1; 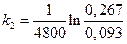 =2,20·10-4с-1;
=2,20·10-4с-1;
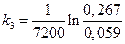 =2,10·10-4 с-1; kср =2,15·10-4 с-1.
=2,10·10-4 с-1; kср =2,15·10-4 с-1.
Пример 2.
Исследовалась кинетика процесса разложения SbH3 на катализаторе из Sb при 25 °С. Давление SbH3 в реакторе менялось во времени следующим образом:
р 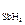 10–2,Н/м2· 10–2,Н/м2·
| 1.013 | 0,740 | 0,516 | 0,331 | 0,191 | 0,074 |
| t,мин |
Считая, что SbH3 сорбируется на катализаторе умеренно (b =1,824·10-5 м2/Н), а продукты разложения не сорбируются совсем, рассчитать константу скорости данного процесса.
Решение.
Скорость процесса зависит от степени заполнения катализатора сорбентом:
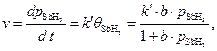 где b – адсорбционная константа Лэнгмюра.
где b – адсорбционная константа Лэнгмюра.
Для средней адсорбции исходного вещества константа скорости процесса может быть рассчитана по уравнению:
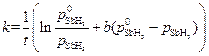 , где
, где 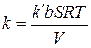 .
.
Подсчитаем значения констант в различные моменты времени протекания реакции.
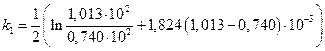 =0,157 мин-1;
=0,157 мин-1;  =0,169 мин-1;
=0,169 мин-1; 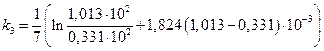 =0,160 мин-1;
=0,160 мин-1;
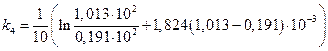 =0,167 мин-1;
=0,167 мин-1;
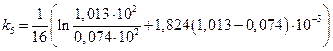 =0,156 мин-1.
=0,156 мин-1.
kср =0,162·мин-1.
Дата добавления: 2016-01-09; просмотров: 1148;
