Основные стадии гетерогенно-каталитических реакций
Из чисто физических представлений сложный гетерогенно-каталитический процесс можно разделить на 5 стадий:
1)транспорт реагирующих веществ к поверхности катализатора;
2)адсорбция реагирующих веществ на поверхности катализатора;
3)химическая реакция на поверхности катализатора;
4)десорбция продуктов реакции с регенерацией катализатора;
5)транспорт продуктов реакции в объеме реакционной смеси.
В зависимости от условий проведения процесса и его особенностей лимитирующей может быть любая из пяти стадий, а значит, она и будет определять скорость всего процесса.
Скорость этого сложного процесса определяется, кроме того, скоростью стадии, предваряющей стадию адсорбции, т.е. стадии доставки вещества реагентов к поверхности катализатора, а это диффузионный по своему характеру процесс.
Диффузиейназывается перемещение молекул вещества в неподвижной среде под влиянием градиента концентрации. Скорость диффузии - это количество вещества, проходящее через данное поперечное сечение в единицу времени. Количественные закономерности кинетики диффузионно-контролируемых химических реакций описываются двумя законами Фика.
Первый закон Фика:
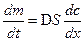 , (5.64)
, (5.64)
где dm – количество вещества, проходящее за время dt через поверхность S; D - коэффициент диффузии, м2/с или см2/с; dС/dх– градиент концентрации.
Второй закон Фика, определяющий скорость процесса нестационарной диффузии:
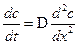 . (5.65)
. (5.65)
Константа скорости диффузионного процесса увеличивается с повышением температуры по закону, аналогичному уравнению Аррениуса:
D= k×e–E/RT. (5.66)
Однако, величина Е в этом случае редко превышает 4¸8 кДж/моль , т.е. во много раз меньше энергии активации большинства химических реакций. Следовательно, с повышением температуры скорость диффузии будет расти значительно медленнее, чем скорость химической реакции. Это позволяет определить на практике, какая стадия лимитирует скорость протекания гетерогенной каталитической реакции.
Критерием того, что скорость данной химической реакции лимитируется диффузией, может служить значение температурного коэффициента скорости диффузии g, который может изменяться в пределах от 1,1 до 1,2.
Если реакция лимитируется химическим взаимодействием, то значение температурного коэффициента константы скорости может изменяться в пределах от 2 до 4.
Одной из важных стадий каталитического процесса является адсорбция реагирующих молекул из газовой фазы или раствора на поверхности катализатора. Различают физическую и химическую или активированную адсорбцию.
Физическая адсорбция обусловлена силами межмолекулярного взаимодействия (силы ван-дер-ваальса) частиц (атомов, молекул, ионов) твердой фазы катализатора с частицами газовой фазы или раствора. Это обратимый процесс.
Химическая адсорбция (хемосорбция) обусловлена действием химических валентных сил, в результате чего происходит переход электронов на новые молекулярные орбитали с возникновением связей ковалентного или полярного характера.
Хемосорбция сопровождается большими тепловыми эффектами (400 кДж/моль и больше). Теплоты физической адсорбции в десятки раз меньше. Адсорбция, как самопроизвольный процесс, сопровождается уменьшением энергии Гиббса (DG < 0), возрастанием упорядоченности системы, а, следовательно, и уменьшением энтропии. Поэтому адсорбция является экзотермическим процессом (DH<0). При повышении температуры адсорбция уменьшается, при этом происходит переход от физической адсорбции в области низких температур к хемосорбции при повышенных температурах.
Простейшим уравнением адсорбции является так называемая изотерма адсорбции Лэнгмюра, при выводе которой сделаны следующие исходные упрощения:
1) все активные центры поверхности адсорбента (катализатора в нашем случае) энергетически равноценны;
2) между адсорбированными частицами отсутствует взаимодействие;
3) один активный центр адсорбента занимается только одной частицей реагента.
При достаточной концентрации реагентов поверхность адсорбента покрывается монослоем частиц реагентов (адсорбата). Исходя из этих условий и считая, что скорость адсорбции пропорциональна поверхности катализатора (адсорбента), доле его свободной поверхности (1- 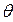 ) и концентрации или давлению вещества в растворе или в объеме газа, Лэнгмюр вывел уравнение адсорбции компонента из раствора:
) и концентрации или давлению вещества в растворе или в объеме газа, Лэнгмюр вывел уравнение адсорбции компонента из раствора:

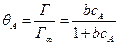 (5.67)
(5.67)
и уравнение адсорбции из газовой фазы:
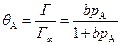 , (5.68)
, (5.68)
где 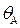 - степень заполнения поверхности веществом А; Г – величина адсорбции частиц реагентов А, моль/м2; Г¥ – предельное количество вещества, которое может сорбироваться на катализаторе в заданных условиях, моль/м2; сА – концентрация вещества в объемной фазе, моль/л; рА – парциальное давление компонента А в газовой фазе;
- степень заполнения поверхности веществом А; Г – величина адсорбции частиц реагентов А, моль/м2; Г¥ – предельное количество вещества, которое может сорбироваться на катализаторе в заданных условиях, моль/м2; сА – концентрация вещества в объемной фазе, моль/л; рА – парциальное давление компонента А в газовой фазе;
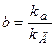 , (5.69)
, (5.69)
где kа, kД– константы скоростей процессов адсорбции и десорбции;
b– константа равновесия процессов адсорбции и десорбции.
Дата добавления: 2016-01-09; просмотров: 1015;
