Порядки гетерогенно-каталитических реакций
Рассмотрим реакцию, протекающую на поверхности катализатора:
nАА+nВВ = nСС+nDD.
Пусть процессы массопереноса не тормозят реакцию; поверхность катализатора равнодоступна; все вещества – газы. Так как реакция протекает на поверхности катализатора, то в уравнение формальной кинетики должны входить не парциальные давления реагентов, а обычно неизвестные концентрации реагентов на поверхности катализатора. Поэтому Лэнгмюр предложил использовать в этом случае вместо закона действующих масс аналогичный закон действующих поверхностей, согласно которому 
 , (5.70)
, (5.70)
где  qА , qВ ,...– доля поверхности катализатора, занятая соответствующим компонентом; q0 – доля свободной поверхности; Dn – разность между числом образующихся и вступающих в реакцию молекул. Множитель q0Dn– учитывает необходимость наличия на поверхности свободных мест для размещения продуктов реакции. Если Dn £ 0, то этот множитель приравнивается единице.
qА , qВ ,...– доля поверхности катализатора, занятая соответствующим компонентом; q0 – доля свободной поверхности; Dn – разность между числом образующихся и вступающих в реакцию молекул. Множитель q0Dn– учитывает необходимость наличия на поверхности свободных мест для размещения продуктов реакции. Если Dn £ 0, то этот множитель приравнивается единице.
Рассмотрим, как влияет адсорбция на кинетическое уравнение скорости гетерогенно-каталитической реакции.
Если лимитирующей стадией суммарного процесса является химическая реакция на поверхности катализатора, т.е. в адсорбционных стадиях устанавливается равновесие, тогда зависимость qi от рi может быть найдена по уравнению изотермы адсорбции этого компонента.
Для примера рассмотрим расчет скорости простейшей мономолекулярной гетерогенной каталитической реакции:
А ® В.
В этом случае Dn = 0, и скорость процесса v = kqА . Зависимость равновесной степени покрытия поверхности катализатора компонентом А , т.е. от pА по теории Лэнгмюра, выражается формулой:
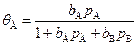 , (5.71)
, (5.71)
где bА и bВ – адсорбционные коэффициенты веществ А и В, тогда скорость процесса:
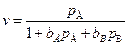 , (5.72)
, (5.72)
где k1 = k×bА.
Это уравнение позволяет качественно объяснить наблюдаемые на опыте зависимости кинетического порядка реакции от типа химического взаимодействия реагентов на поверхности катализатора.
1. Если адсорбция вещества Аслабая (bА<< 1), а продукты реакции не сорбируются катализатором (bBpB = 0), то bA∙pA+bB∙pB<<1, поэтому скорость реакции равна:
v = k1pA, (5.73)
то есть порядок мономолекулярной реакции равен 1.
2. При сильной адсорбции исходного вещества bApA>>1, когда продукт реакции В адсорбируется слабо или вообще не адсорбируется, скорость гетерогенной каталитической реакции равна:
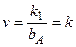 , (5.74)
, (5.74)
то есть наблюдается нулевой порядок реакции по реагирующему веществу А.
3. При средних значениях адсорбции исходного вещества, в соответствии с уравнением (5.72), порядок реакции должен быть дробным.
4. Если образующийся продукт реакции Всильно адсорбируется, а адсорбция вещества А слабая, то bB·рB>>(1+ bA·рA), тогда:
 , (5.75)
, (5.75)
где  . В таких случаях порядок реакции по реагирующему веществу первый, но процесс тормозится образующимися при реакции веществами.
. В таких случаях порядок реакции по реагирующему веществу первый, но процесс тормозится образующимися при реакции веществами.
Дата добавления: 2016-01-09; просмотров: 1364;
