Основные методы качественного и количественного анализа биологически активных веществ в лекарственном растительном сырье
Современная нормативная документация на лекарственное растительное сырьё в качестве одного из важнейших показателей обязательно включает обнаружение и нормирование содержания основных биологически активных веществ. Их определение проводится с использованием химических, физико-химических и биологических методов.
Анализируемая группа веществ или индивидуальное вещество предварительно извлекаются из растительного сырья. Чаше всего используют экстракцию растворителями, в результате которой получают смесь компонентов; затем проводят очистку от примесей, делят на отдельные фракции и/или выделяют индивидуальные вещества, используя преимущественно хроматографические методы.
Для анализа эфирных масел используют перегонку с водяным паром. Содержание эфирного масла в растительном сырье определяется способами, описанными в ГФ XI, вып. 1. Количество перегнанного масла измеряют с помощью специальных устройств и рассчитывают в весо-объёмных процентах.
К химическим можно отнести методы анализа, в основе которых лежат химические реакции. Для идентификации действующих веществ используют групповые цветные и осадительные химические реакции. К традиционным методам количественного химического анализа относятся гравиметрические и титриметрические методы.
Гравиметрический (весовой) анализ основан на выделении суммы веществ путём их осаждения из различных растворителей или за счёт получения нерастворимых комплексных соединений и последующем установлении массы взвешиванием осадка на аналитических весах (например, определение полисахаридов в листьях подорожника и траве череды).
Титриметрические (объёмные) методы весьма разнообразны и зависят от химических свойств исследуемых соединений. Для этих целей используются методы прямого и обратного титрования. В основу титриметрических методов могут быть положены реакции следующих типов: кислотно-основные, окислительно-восстановительные, реакции осаждения и образования комплексных соединений. Для некоторых оснований и кислот, титрование которых в воде затруднено или невозможно из-за слабых кислотно-основных свойств или малой растворимости (например, некоторые алкалоиды, аминокислоты и пр.), проводят определение в неводных растворах. Широко распространены методы титрования окислителями — перманганатометрия (определение дубильных веществ в сырье), йодометрия (определение арбутина в листьях толокнянки и брусники) и др. Точку эквивалентности фиксируют с помощью цветных индикаторов или потенциометрически (за счёт скачка потенциала индикаторного электрода). Потенциометрическое титрование в анализе лекарственного растительного сырья используется сравнительно редко, например при количественном определении суммы аралозидов в корнях аралии маньчжурской.
Современные физико-химические методы анализа имеют ряд преимуществ перед классическими химическими методами. На сегодняшний день существует большое количество аналитических приборов, выпускаемых отечественными и зарубежными фирмами и позволяющих анализировать практически любые органические соединения, содержащиеся в природных объектах. Они отличаются избирательностью, высокой чувствительностью, высокой степенью автоматизации.
К наиболее широко распространённым в настоящее время современным методам анализа растительного сырья относятся хроматографические методы и методы фотометрического анализа. Важнейшей особенностью этих методов является объективность оценки количественного содержания фармакологически активных веществ, что, в свою очередь, определяет качество растительного сырья.
Хроматографические методы анализа используются для разделения смеси веществ или частиц (например, ионов) и основаны на различии в скорости их перемещения в системе несмешивающихся и движущихся относительно друг друга фаз. Поэтому хроматография применяется как на этапе пробоподготовки (очистки анализируемого компонента или смеси компонентов от сопутствующих примесей), так и в ходе непосредственного качественного и количественного анализов. При этом идентификация компонентов проводится по параметрам их удерживания в сравнении со стандартными образцами (свидетелями). Определение содержания искомых соединений или их групп в исходной смеси после хроматографического разделения проводится другими физико-химическими методами в зависимости от способа детекции.
По механизму разделения различают следующие виды хроматографии, применяемые в анализе лекарственного растительного сырья.
Адсорбционная хроматография, в основе которой лежит непрерывный обмен хроматографируемым веществом между неподвижной (твёрдой или жидкой) и подвижной фазами, обусловленный существованием на поверхности раздела фаз динамического равновесия между процессами адсорбции и десорбции хроматографируемого вещества, растворённого в подвижной фазе.
Распределительная хроматография, в основе которой лежит процесс непрерывного перераспределения хроматографируемого вещества между подвижной и неподвижной фазами, причём это вещество растворимо в каждой из фаз.
Ионообменная хроматография, в основе которой лежит обратимая хемосорбция ионов анализируемого раствора ионогенными группами сорбента. В зависимости от характера ионогенных групп ионообменные сорбенты (иониты) подразделяются на катионообменные (катиониты) и анионообменные (аниониты). Ионообменная хроматография в современном фармакогностическом анализе применяется весьма ограниченно, главным образом для очистки анализируемых компонентов от сопутствующих примесей.
В анализе лекарственного растительного сырья применяется несколько методов хроматографического разделения, подразумевающих соответствующее аппаратурное оформление.
Адсорбционная хроматография на колонках используется главным образом для очистки анализируемых компонентов от сопутствующих примесей. Классическая хроматографическая колонка представляет собой стеклянную трубку, заполненную сорбентом. Для разделения и очистки соединений растительного происхождения чаще всего используют полиамидный сорбент и силикагель, реже применяют колоночную хроматографию на сефадексе и алюминия оксиде. Так, очистку суммы флавоноидов травы сушеницы топяной и плодов боярышника, суммы ксантонов в траве золототысячника проводят с помощью адсорбционной хроматографии на полиамидном сорбенте. Затем в полученном элюате спектрофотометрическим методом определяют содержание действующих веществ.
Как вариант адсорбционной и/или распределительной колоночной хроматографии для очистки многокомпонентных смесей растительного происхождения в последнее время всё чаще применяется метод твёрдо-фазной экстракции (ТФЭ). ТФЭ отличается от классической колоночной хроматографии прежде всего принудительной подачей элюента под действием вакуума на выходе из хроматографической системы. Для получения разрежения определенной величины используют специальное герметичное устройство-приёмник (манифолд), в верхней части которого крепятся хроматографические «колонки» (патроны и/или картриджи), а к нижней подключен вакуум-насос с электроприводом. На мировом рынке системы для ТФЭ предлагаются фирмой «Supelco» (США).
Тонкослойная хроматография, или ТСХ (адсорбционная хроматография в тонком слое сорбента), чаще всего применяется при качественном анализе лекарственного растительного сырья или на стадии пробоподготовки для очистки анализируемых компонентов (рис. 4).
Используют хроматографические пластины с закреплённым или незакрепленным слоем сорбента. Наиболее распространены сорбенты на основе силикагеля, реже применяют алюминия оксид, целлюлозу или полиамидный сорбент. Качественный анализ компонентов лекарственного растительного сырья с применением ТСХ проводят путём детекции невооруженным глазом флуоресценции или окраски пятен в УФ и видимом свете при сравнении со свидетелями. Основным параметром при этом, наряду с характерным окрашиванием или флуоресценцией пятен, является относительное удерживание компонентов, или Rf. Использование метода ТСХ на стадии пробоподготовки в количественном анализе лекарственного растительного сырья предусматривает элюирование действующих веществ с хроматографической пластины и последующий анализ элюата другими методами. Например, разделение суммы флавоноидов цветков боярышника проводят на пластинах «Силуфол» или «Сорбфил», после чего пятно гиперозида элюируют с пластины, а его содержание в элюате определяют спектрофотометрическим методом.
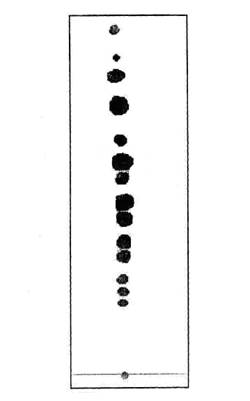
Рис. 4. Хроматограмма на пластине гинсенозидов экстракта женьшеня.
В последнее время активно развивается метод количественной ТСХ с использованием специального прибора — денситометра, работа которого основана на измерении плотности флуоресценции или окраски пятна анализируемого компонента непосредственно на пластине. Для этого денситометр снабжён цифровой видеокамерой или сканером, а обработка полученных результатов производится с помощью специальной программы на компьютере. Применение денситометрии позволяет проводить экспресс-анализ компонентов сырья без их элюирования с пластины. Производство денситометров активно развивается как в России, так и за рубежом. На российском рынке в настоящее время представлена продукция отечественного производителя «ЛенХром», Санкт-Петербург (денситометр «ДенСкан») и швейцарской фирмы «Camag» (спектро-денситометр «САМAG Scanner 3»).
Использование хроматографии на бумаге (БХ), имеющей как распределительный, так и адсорбционный механизмы разделения компонентов, в настоящее время ограничено и применяется для качественного анализа лекарственного растительного сырья. По способу перемещения подвижной фазы различают восходящую, нисходящую и круговую БХ. Детекцию осуществляют сходным с ТСХ образом. Так, качественный анализ флавонолов листьев вахты трёхлистной проводят с помощью восходящей БХ с последующим проявлением хроматограммы раствором алюминия хлорида.
В самом общем виде все перечисленные методы хроматографии не требуют специального аппаратурного оформления, за исключением количественной ТСХ и твёрдо-фазной экстракции. К строго приборным методам хроматографического анализа относятся газовая и высокоэффективная жидкостная хроматография.
Газовая хроматография (ГХ) - это хроматография, в которой подвижная фаза находится в состоянии газа или пара. В фармацевтическом анализе находят применение газожидкостная (ГЖХ) и газоадсорбционная хроматографии. В газожидкостной хроматографии неподвижной фазой служит жидкость, нанесённая на твёрдый носитель, т.е. используется распределительный механизм разделения компонентов. В газоадсорбционной хроматографии неподвижной фазой является твёрдый адсорбент.
Метод газовой хроматографии применяется для анализа летучих веществ (рис. 5), в том числе компонентов эфирных масел, например ледола и палюстрола в эфирном масле побегов багульника болотного.
Также возможно проведение химической модификации (дериватизации) компонентов анализируемой смеси с целью получения летучих производных и их последующий анализ методом ГХ. В качестве примера газохроматографического анализа с использованием дериватизации можно привести анализ летучих производных карбоновых кислот и моносахаридов, в том числе и растительного происхождения.
Детектирование на выходе из газохроматографической системы производится несколькими способами. Наиболее часто применяют детекторы теплопроводности (ДТП, или катарометр) и пламенно-ионизационный (ПИД). Реже используют селективные детекторы, такие как электронно-захватный (ЭЗД) и термоионный (ТИД).
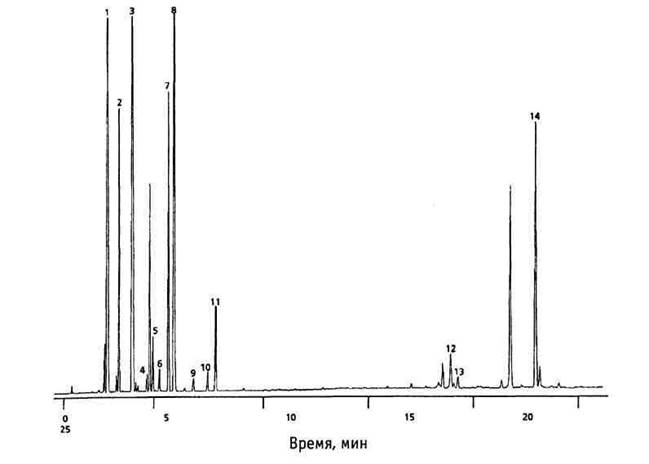
Рис. 5. Хроматограмма скипидара, полученная методом ГЖХ.
Колонка DB-WAX 30 м Ч 0,25 мм, газ-носитель водород, градиент температур 70-200 ºС (3 ºС/мин), ПИД (220 ºС):
1 – альфа-пинен; 2 – камфен; 3 – бета-пинен; 4 – 3-карен; 5 – альфа-фелландрен; 6 – альфа-терпинен; 7 – лимонен; 8 – бета-фелландрен; 9 – гамма-терпинен; 10 – пара-цимен; 11 – терпинолен; 12 – кариофиллен; 13 – терпинен-4-ол; 14 – альфа-терпинеол.
На базе колоночной хроматографии возникла высокоэффективная жидкостная хроматография (ВЭЖХ). От классической колоночной хроматографии ВЭЖХ отличается использованием сорбентов с размером частиц 3-10 мкм, что обеспечивает быстрый массоперенос при очень высокой эффективности разделения. Для обеспечения беспрепятственного прохождения элюента через колонку с ультрамелким сорбентом на входе в хроматографическую систему создается высокое давление. Поэтому другим названием ВЭЖХ является «жидкостная хроматография высокого давления».
Лидирующее положение занимает обращённо-фазовая ВЭЖХ, в которой используются сорбенты на основе силикагеля с привитыми на его поверхности молекулами неполярных соединений, таких как высокомолекулярные углеводороды, фенолы и их производные. При этом хроматографическое разделение происходит за счёт распределительного (главным образом) и адсорбционного (в меньшей степени) механизмов, детектирование в ВЭЖХ осуществляется с помощью фотометрических и электрохимических методов анализа. Основное значение имеет спектрофотометрическая детекция в УФ области.
Преимуществом ВЭЖХ (особенно обращённо-фазовой) перед газовой хроматографией является возможность исследования практически любых объектов без каких-либо ограничений по их физико-химическим свойствам. Поэтому подавляющее большинство действующих веществ лекарственного растительного сырья может быть проанализировано этим методом (рис. 6). В фармацевтическом анализе метод ВЭЖХ в настоящее время используется главным образом при анализе препаратов на основе лекарственного растительного сырья, такого как женьшень, родиола розовая, шиповник и др.
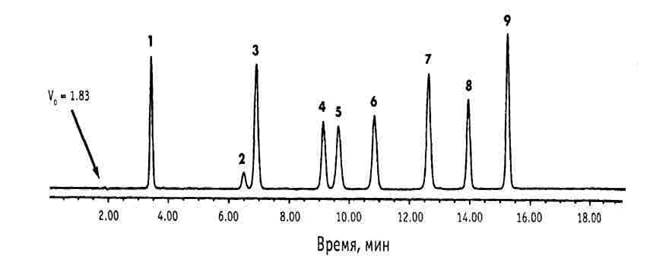
Рис. 6. Хроматограмма смеси фенольных соединений, полученная методом ВЭЖХ.
Колонка Atlantis 4,6 Ч 150 мм (5 µм), метанол – вода – 1 % HCOOH (pH 2,3), градиентный режим; скорость потока 1 мл/мин; температура колонки 30 ºС; спектрофотометрическая детекция (280 нм):
1 – кислота галловая; 2 – эпигаллокатехин; 3 – катехин; 4 – кофеин; 5 – эпигаллокатехингаллат; 6 – эпикатехин; 7 – галлокатехингаллат; 8 – эпикатехингаллат; 9 – катехингаллат.
Для проведения анализа методами ГЖХ и ВЭЖХ используются аналитические приборы - хроматографы. Количество отечественных и зарубежных фирм-производителей, выпускающих газовые и жидкостные хроматографы, неуклонно растёт, поэтому перечислим только некоторые из них. Из отечественных фирм-производителей устойчивую нишу на российском рынке занимают фирма «Аквилон», Москва (жидкостные хроматографы «Стайер»), ЗАО «ЭкоНова», Новосибирск (микроколоночный жидкостный хроматограф «Милихром А-02») и СКВ «Хроматэк», Йошкар-Ола (газовые хроматографы «Кристалл»). Огромный спектр продукции для ГХ и ВЭЖХ выпускается иностранными фирмами: «Agilent technologies», «Hewlett Packard», «Waters», «Neolab» (США), «Shimadzu» (Япония-Германия), «Knauer» (Германия).
Фотометрические методы анализа основаны на поглощении электромагнитного излучения индивидуальным веществом или группой анализируемых веществ.
Наибольшее распространение в применении к фармакогностическому анализу получило электромагнитное излучение ультрафиолетового (УФ) и видимого (ВИД) диапазонов (обычно принято считать видимым излучение с длиной волны от 800 до 400 нм, а ультрафиолетовым - от 400 до 200 нм, длина волны меньше 200 нм - далекий УФ).
В зависимости от используемой аппаратуры, различают спектрофотометрический и фотоколориметрический анализ, к последнему близко примыкает колориметрический.
Спектрофотометрический анализ — анализ поглощения веществом монохроматического излучения с определённой длиной волны. Здесь выполняется основной закон поглощения - закон Бугера-Ламберта-Бэра:
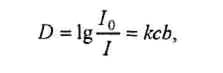
где I0 - интенсивность излучения, падающего на раствор; I - интенсивность излучения, прошедшего через раствор; c - концентрация вещества в растворе; b - толщина слоя, см; D - оптическая плотность; k - коэффициент поглощения вещества.
Этот вид анализа выполняется на спектрофотометрах ВИД и УФ диапазона (обычно 200-1100 нм). Регистрируется спектр поглощения (зависимость поглощенного излучения от длины волны) или часть спектра поглощения (отдельная полоса поглощения). Измерение оптической плотности производится на фиксированной длине волны (как правило, в максимуме полосы поглощения).
В настоящее время рынок выпускаемых фирмами-производителями спектрофотометров УФ и ВИД диапазона очень широк. Из отечественных приборов наиболее распространены спектрофотометры, выпускаемые фирмой «ЛОМО» (Санкт-Петербург) - «СФ-56», «СФ-2000/2001»; фирмой «Аквилон» (Москва) - «СФ-101», «СФ-103», «СФ-201». Из зарубежных - спектрофотометры фирмы «Shimadzu» (Япония) - «UVmini-1240», «UV-1700 PharmaSpec», «UV-2401/2501 PC», фирмы «Analytic Jena» (Германия) - «Specord-200», «Specord-50/40/30», «Specol 1100/1200» и др.
Все выпускаемые приборы являются сканирующими, с автоматической записью спектра и управляются компьютерами или встроенными процессорами (для компактных моделей). Они оснащены разнообразными программными продуктами, позволяющими оперативно решать различные спектрофотометрические задачи. Разнообразие выпускаемых приборов определяется целями анализа — рутинный поточный анализ или решение сложных аналитических задач.
Фотоколориметрический анализ — анализ поглощения веществами немонохроматического излучения, которое получается с помощью светофильтров, выделяющих сравнительно узкий интервал длин волн (20-40 нм).
При фотоколориметрическом анализе закон Бугера-Ламберта-Бэра применим с большей или меньшей степенью приближения в зависимости от степени постоянства величины оптической плотности (D) в данном интервале длин волн.
Приборы, используемые для такого вида анализа, позволяют измерить оптическую плотность лишь в интервале длин, выделяемых светофильтрами. Для этих целей используются фотоэлектроколориметры различных типов (например, ФЭК или КФК).
Колориметрический анализ основан на сравнении интенсивностей окрасок растворов разных концентраций визуально или при помощи несложных приборов - колориметров.
Фотометрические измерения обычно проводят в водных или спиртовых растворах.
При анализе растительного сырья наиболее распространено количественное определение суммы действующих веществ в пересчёте на конкретное соединение, которое должно отвечать определённым требованиям: это соединение должно входить в состав суммы действующих веществ и для него должен существовать государственный стандартный образец (ГСО). Например, в траве зверобоя спектрофотометрически оценивается содержание суммы флавоноидов в пересчёте на рутин. В случаях отсутствия ГСО, в качестве стандарта используют иное соединение, имеющее сходный с определяемым коэффициент поглощения на аналитической длине волны. Подобным приёмом пользуются при фотоколориметрическом определении суммы антраценпроизводных, где в качестве стандарта используют кобальта хлорид (кора крушины, корни ревеня и др.).
Определение концентрации веществ в растворе проводят тремя основными способами.
Первый способ основывается на измерении оптической плотности с последующим применением закона Бугера-Ламберта-Бэра для расчёта концентрации. Этот способ применим, когда известен коэффициент поглощения исследуемого вещества на данной длине волны. Таким образом определяют количественное содержание суммы антоцианов в пересчёте на цианидин-3,5-дигликозид в цветках василька синего.
Второй способ — определение концентрации исследуемого соединения путём сравнения величин оптических плотностей его раствора и раствора стандартного образца в известной концентрации. Так определяют содержание суммы флавоноидов в пересчёте на изосалипурпозид в цветках бессмертника песчаного.
Третий способ — построение калибровочного графика с использованием серии растворов стандартного образца известной концентрации, например количественное определение суммы флавоноидов в пересчёте на ононин в корнях стальника.
Современный фармакогностический анализ также предусматривает использование многих других физико-химических методов. При выделении из растений органических веществ, требующих идентификации и определения их количественного содержания, успешно используются такие методы, как поляриметрия, люминесцентный анализ, ИК-спектроскопия, спектроскопия ядерного магнитного резонанса, хромато-масс-спектрометрия, электрохимические методы и др.
В тех случаях, когда качество лекарственного сырья невозможно удовлетворительно определить химическими или физико-химическими методами, используют биологический анализ. Этот метод, в частности, является определяющим при анализе лекарственного растительного сырья, содержащего кардиотонические гликозиды. Следует отметить, что биологическая стандартизация имеет ряд существенных недостатков: трудоёмкость, высокая стоимость анализа, малая точность. Кроме того, биологические методы анализа зачастую не отражают истинного содержания действующих веществ в лекарственном растительном сырье.
Дата добавления: 2015-11-28; просмотров: 6928;
