Энергетические диаграммы двухатомных частиц, образованных элементами второго периода
У атомов элементов второго периода кроме 1s-орбиталей в образовании молекулярных орбиталей принимают участие 2s-, 2рx-,2рy-,2рz-орбитали. Заполненные орбитали 1s и 2s не принимают участия в образовании химической связи, так как число электронов на связывающих и разрыхляющих МО одинаково. При комбинациях атомных 2s-орбиталей образуются две молекулярные орбитали: связывающая σs и разрыхляющая σs*. Если принять, что атомы расположены по оси z, то комбинация атомных 2pz- орбиталей даёт молекулярные орбитали σz и σz* , а комбинация двух
2px-орбиталей – молекулярные орбитали πx и πx* ,а двух 2py-орбиталей — молекулярные орбитали πy и πy*. Так как энергия 2рx- и 2рy - орбиталей одинакова, и они перекрываются одинаковым способом, то равны энергии соответствующих молекулярных орбиталей:
Е( πx) = Е( πy) и Е (πx*) = Е( πy*). При равенстве энергий орбитали πx и πy различаются ориентацией в пространстве.
Порядок заполнения молекулярных орбиталей для элементов начала второго периода вплоть до азота следующий:
σs < σs* < πx = πy < σz < πx* = πy* < σz*,
а для элементов второго периода (N–Ne):
σs < σs < σz < πx = πy < πx* =πy* < σz*.
Этот порядок был установлен на основании изучения молекулярных спектров.
Подобно электронным формулам, показывающим распределение электронов в атоме по атомным орбиталям, в методе МО составляются формулы молекул, отражающие их электронную конфигурацию. По аналогии с атомными s-, p-, d-, f-орбиталями молекулярные орбитали обозначаются греческими буквами s, p, d, ,j.
Например молекула B2 : σ1s2σ2s*2σ2s2σ2s*2 πx1πy1
а) Образование молекулярных орбиталей в молекуле азота N2
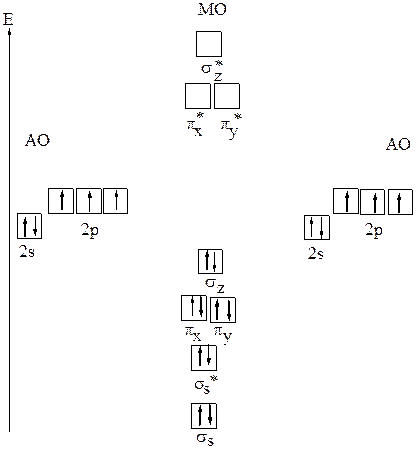
Рис.18 Молекулярные орбитали N2 (без учёта атомных орбиталей 1s)
При комбинация атомных 2s-орбиталей атомов азота образуются две молекулярные орбитали: связывающая σs и разрыхляющая σs*. Если принять, что атомы расположены по оси z, то комбинация атомных 2pz- орбиталей атомов азота даёт молекулярные орбитали σz и σz* , а комбинация двух 2px-орбиталей – молекулярные орбитали πx и πx* ,а двух 2py-орбиталей — молекулярные орбитали πy и πy*. Так как энергия 2рx- и 2рy - орбиталей одинакова, и они перекрываются одинаковым способом, то равны энергии соответствующих молекулярных орбиталей:
Е( πx) = Е( πy) и Е (πx*) = Е( πy*). При равенстве энергий орбитали πx и πy различаются ориентацией в пространстве.
Электронная конфигурация молекулы N2 — σs2σs*2πx2πy2σz2 . Порядок (кратность) связи равен 6/2 =3.В молекуле азота N2 одна σ-связь и две
π-связи. Энергия диссоциации равна 941кДж/моль). Молекула диамагнитна. Структурная формула молекулы N ≡ N.
б) Образование молекулярных орбиталей в ионе N2+
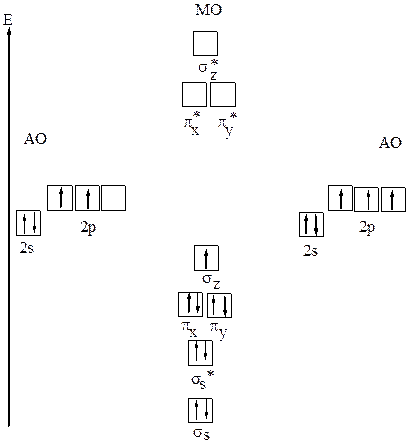
Рис.19 Молекулярные орбитали иона N2+
Электронная конфигурация иона N2+ — σs2σs*2πx2πy2σz1 . Порядок связи равен 5/2 =2,5. В молекулярном ионе азота N2+ одна σ-связь и две π–связи. Потеря электрона со связывающей орбитали сопровождается понижением кратности связи, молекулярный ион N2+ должны быть менее устойчивым. Энергия диссоциации иона меньше, чем у молекулы 843 кДж/моль (у N2 соответственно 941кДж/моль). Ион парамагнитен, так как имеется неспаренный электрон.
в) Образование молекулярных орбиталей в молекуле кислорода
На рис.20 показана энергетическая диаграмма, иллюстрирующая с помощью метода МО ЛКАО парамагнитные свойства молекулы O2
Заполненные орбитали 1s и 2s не принимают участия в образовании химической связи, так как число электронов на связывающих и разрыхляющих МО одинаково. Комбинация атомных 2pz- орбиталей даёт молекулярные орбитали σz и σz* , а комбинация двух 2px-орбиталей – молекулярные орбитали πx и πx* ,а двух 2py-орбиталей — молекулярные орбитали πy и πy*. 8 электронов двух атомов кислорода заселяют молекулярные орбитали по принципу наименьшей энергии, правилу Хунда, принципу Паули. В соответствии с правилом Хунда на разрыхляющих орбиталях πx* и πy* находятся два электрона по одному на каждую орбиталь. Порядок связи в молекуле кислорода равен 2.

Рис.20Энергетическая диаграмма,иллюстрирующая с помощью метода МО ЛКАО парамагнитные свойства молекулы O2
Энергии молекулярных орбиталей могут быть определены по данным спектров поглощения веществ в ультрафиолетовой области. Так, среди молекулярных орбиталей молекулы кислорода, образовавшихся в результате перекрывания p-АО, две
π-связывающие с одинаковой энергией орбитали πx и πy обладают меньшей энергией, чем σ-связывающая, впрочем, как и π*-разрыхляющие орбитали обладают меньшей энергией в сравнении с σ*-разрыхляющей орбиталью .В молекуле O2 два электрона с параллельными спинами оказались на двух с одинаковой энергией разрыхляющих молекулярных орбиталях πx* и πy* (рис.20).Наличием неспаренных электронов и обусловлены парамагнитные свойства молекулы кислорода, которые станут заметными, если охладить кислород до жидкого состояния.
г) Образование молекулярныхз орбиталей в ионе О2+
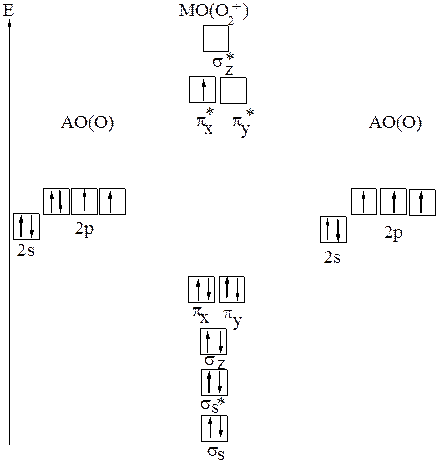
Рис.21 Молекулярные орбитали в ионе О2+
Потеря электрона с разрыхляющей орбитали сопровождается повышением кратности связи, молекулярный ион О2+ должен быть более устойчивым. Энергия диссоциации иона больше, чем у молекулы 642 кДж/моль (у О2 соответственно 494кДж/моль). Ион парамагнитен, так как имеется неспаренный электрон.
д) Образование молекулярных орбиталей в молекуле СО (рис.22)
При комбинация атомных 2s-орбиталей атомов углерода и кислорода образуются две молекулярные орбитали: связывающая σs и разрыхляющая σs*. Комбинация атомных 2pz- орбиталей атомов углерода и кислорода даёт молекулярные орбитали σz и σz* , а комбинация двух 2px-орбиталей – молекулярные орбитали πx и πx* ,а двух 2py-орбиталей — молекулярные орбитали πy и πy*. Электронная конфигурация молекулы СО — σs2σs*2πx2πy2σz2 . Порядок (кратность)связи как и в молекуле азота равен
6/2 =3.В молекуле СО как и в молекуле азота одна σ-связь и две π–связи. Это объясняет значительное сходство в свойствах свободного азота и оксида углерода, например, близки энергии диссоциации: 1076кДж/моль(СО) и 941кДж/моль(N2); межъядерные расстояния– 0,113нм(CO) и 0,110нм(N2);температуры плавления –68К(СО) и 63К(N2), температуры кипения–82К(CO) и 77К(N2). Молекулы диамагнитны.
Структурная формула молекулы C ≡ O.
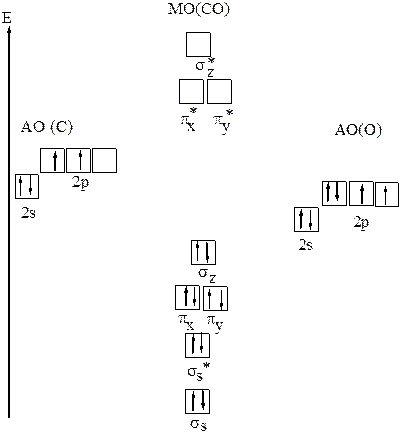
Рис.22 Молекулярные орбитали в СО
Образование молекул из атомов элементов II периода может быть записано следующим образом (К – внутренний электронный слой):
Li 2 [K(σs)2]
Be2 [K(σs)2(σs*)2] молекула не обнаружена, как и молекула Не2
B2 [K(σs)2(σs*)2 (πx)1(πy)1] молекула парамагнитна
C2 [K(σs)2(σs*)2(πx)2(πy)2]
N2 [K(σs)2(σs*)2(πx)2(πy)2(σz)2 ]
O2 [K(σs)2(σs*)2(σz)2(πx)2(πy)2(πx)1(πy)1 ] молекула парамагнитна
F2 [K(σs)2(σs*)2(σz)2(πx)2(πy)2(πx)2(πy)2 ]
Ne2 [KK(σs)2(σs*)2(σz)2 (πx)2(πy)2(πx)2(πy)2(σz*)2 ] молекула не обнаружена
Дата добавления: 2016-01-07; просмотров: 2417;
