Многоатомные молекулы
К многоатомным молекулам применимы те же принципы, что и к двухатомным, однако с увеличением числа атомов в молекуле увеличивается число комбинируемых атомных орбиталей, различающихся как по форме, так и по энергии. Не участвуют в образовании связей электроны, находящиеся на завершенных энергетических уровнях(однако на их долю приходится большой запас энергии), часть валентных электронов, находящихся на несвязывающих молекулярных орбиталях. В многоатомной молекуле наряду с нелокализованными молекулярными орбиталями, охватыващими несколько ядер могут быть и локализованные, охватывающие только два ядра. Таким образом, молекула представляет сложную систему, и поэтому необходимо учитывать большое число факторов, влияющих на полную молекулярную волновую функцию.
Для некоторого упрощения принято для многоатомных молекул молекулярную орбиталь рассматривать как состоящую из орбитали центрального атома и так называемой групповой орбитали. Групповая орбиталь представляет собой результат комбинации орбиталей периферических атомов (лигандов).
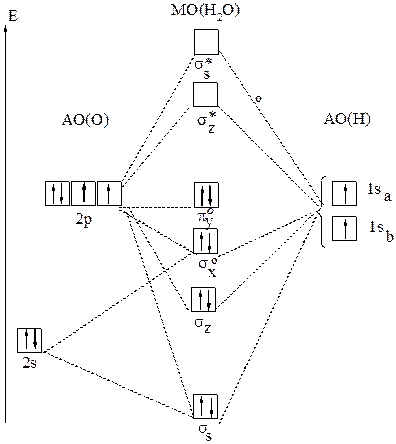
Рис.23 Молекулярные орбитали в Н2О
Рассмотрим трёхатомную молекулу Н2О. Она имеет угловую форму. Роль центрального играет атом кислорода, а атомы водорода—роль лигандов. Молекулярные орбитали Н2О образуются за счёт 2s- и
2p- орбиталей кислорода и 1s-орбиталей двух атомов водорода. Перекрывание 2pz- орбиталей атома кислорода и 1s-орбиталей двух атомов водорода приводит к образованию молекулярных орбиталей: связывающей σz и разрыхляющей σz*.Перекрывание 2s- и 2px- орбиталей приводит к образованию связывающей σs и разрыхляющей σs* орбиталей. Орбиталь 2py не перекрывается и в молекуле Н2О играет роль несвязывающей. Таким образом, комбинация четырёх атомных орбиталей кислорода и двух орбиталей атомов водорода приводит к образованию двух связывающих(σs и σz), двух несвязывающих(σxо и πyо) и двух разрыхляющих(σs* и σz*) молекулярных орбиталей (рис.23).
(Метод молекулярных орбиталей применительно к комплексным соединениям см главу Комплексные соединения)
Дата добавления: 2016-01-07; просмотров: 1281;
