Гибридизация атомных орбиталей и геометрия молекул
Важной характеристикой молекулы, состоящей более чем из двух атомов, является ее геометрическая конфигурация. Она определяется взаимным расположением атомных орбиталей, участвующих в образовании химических связей.
Для объяснения геометрической конфигурации молекулы используется представление о гибридизации АО центрального атома. Возбужденный атом бериллия имеет конфигурацию 2s12p1, возбужденный атом бора – 2s12p2 и возбужденный атом углерода – 2s12p3. Поэтому можно считать, что в образовании химических связей могут участвовать не одинаковые, а различные атомные орбитали. Например, в таких соединениях как BeCl2, BCl3,CCl4 должны быть неравноценные по энергии и направлению связи. Однако экспериментальные данные показывают, что в молекулах, содержащих центральные атомы с различными валентными орбиталями
(s, p, d), все связи равноценны. Для устранения этого противоречия Полинг и Слейтер предложили концепцию гибридизации
Основные положения концепции гибридизации:
1. Гибридные орбитали образуются из различных атомных орбиталей, не сильно отличающиеся по энергиям,
2. Число гибридных орбиталей равно числу атомных орбиталей, участвующих в гибридизации.
3. Гибридные орбитали одинаковы по форме электронного облака и по энергии.
4 По сравнению с атомными орбиталями они более вытянуты в направлении образования химических связей и поэтому обусловливают лучшее перекрывание электронных облаков.
Следует отметить, что как физический процесс гибридизация орбиталей не существует. Метод гибридизации представляет собой удобную модель наглядного описания молекул.
Sp- гибридизация
sp–Гибридизация имеет место, например, при образовании галогенидов Be, Zn, Co и Hg (II). В валентном состоянии все галогениды металлов содержат на соответствующем энергетическом уровне s - и p-неспаренные электроны. При образовании молекулы одна s- и одна р-орбиталь образуют две гибридные sp-орбитали под углом 180о(рис.5).
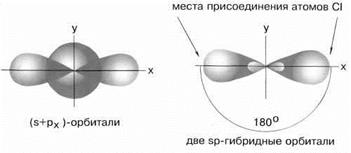
Рис.5 sp-гибридные орбитали
Экспериментальные данные показывают, что все галогениды Be, Zn, Cd и Hg (II) линейны, и обе связи имеют одинаковую длину.
sp2-гибридизация
В результате комбинации одной s-орбитали и двух p-орбиталей образуются три гибридные sp2-орбитали, расположенные в одной плоскости под углом 120о друг к другу. Такова, например, конфигурация молекулы BF3 (рис.6):
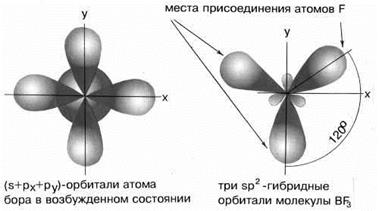
Рис.6sp2-гибридные орбитали
sp3-гибридизация
sp3-Гибридизация характерна для соединений углерода. В результате комбинации одной s-орбитали и трех р-орбиталей образуются четыре гибридные sp3-орбитали, направленные к вершинам тетраэдра с углом между орбиталями 109,5о. Гибридизация проявляется в полной равноценности связей атома углерода с другими атомами в соединениях, например, в CH4, CCl4, C(CH3)4 и др.(рис.7).
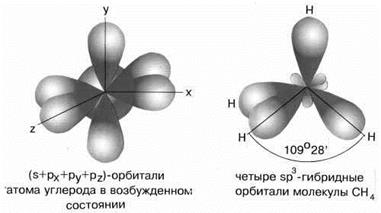
Рис.7 sp3-гибридные орбитали
Метод гибридизации объясняет геометрию молекулы аммиака. В результате комбинации одной 2s и трёх 2p орбиталей азота образуются четыре гибридные орбитали sp 3 . Конфигурация молекулы представляет из себя искажённый тетраэдр, в котором три гибридных орбитали участвуют в образовании химической связи, а четвёртая с парой электронов – нет. Углы между связями N-H не равны 90 о как в пирамиде, но и не равны 109,5 о ,соответствующие тетраэдру(рис.8):

Рис.8 sp3- гибридизация в молекуле аммиака
При взаимодействии аммиака с ионом водорода H+ + ׃NH3 = NH4+ в результате донорно-акцепторного взаимодействия образуется ион аммония, конфигурация которого представляет собой тетраэдр.
Гибридизация объясняет также отличие угла между связями О–Н в угловой молекуле воды. В результате комбинации одной 2s и трёх 2p орбиталей кислорода образуются четыре гибридных орбитали sp3, из которых только две участвуют в образовании химической связи, что приводит к искажению угла, соответсвующего тетраэдру (рнс.9):

Рис 9sp3-гибридизация в молекуле воды
В гибридизацию могут включаться не только s- и р-, но и d- и f-орбитали.
При sp3d2-гибридизации образуется 6 равноценных облаков. Она наблюдается в таких соединениях как [SiF6]4-, [Fe(CN)6]4-(рис.10). При этом молекула имеет конфигурацию октаэдра:
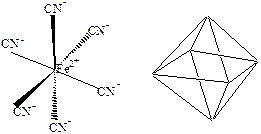
Рис. 10d2sp3-гибридизация в ионе [Fe(CN)6]4-
Представления о гибридизации дают возможность понять такие особенности строения молекул, которые не могут быть объяснены другим способом. Гибридизация атомных орбиталей (АО) приводит к смещению электронного облака в направлении образования связи с другими атомами. В результате области перекрывания гибридных орбиталей оказываются больше, чем для чистых орбиталей и прочность связи увеличивается.
Делокализованная π-связь
По методу МВС электронная структура молекулы выглядит как набор различных валентных схем (метод локализованных пар). Но, как оказалось, нельзя объяснить экспериментальные данные о структуре многих молекул и ионов, оперируя только представлениями о локализованной связи. Исследования показывают, что всегда локализованными являются только σ-связи. При наличии π-связей может иметь место делокализация, при которой связующая электронная пара одновременно принадлежит более чем двум атомным ядрам. Например, экспериментально установлено,что молекула BF3 имеет плоскую треугольную форму(рис.6). Все три связи
B–F равноценны, однако величина межъядерного расстояния свидетельствует, что связь является промежуточной между одинарной и двойной. Объяснить эти факты можно следующим образом. У атома бора в результате комбинации одной s-орбитали и двух p-орбиталей образуются три гибридные sp2-орбитали, расположенные в одной плоскости под углом 120о друг к другу, но остаётся неиспользованной свободная негибридизированная р-орбиталь, а атoмы фтора имеют неподелённые электронные пары. Поэтому имеется возможность образования π –связи по донорно- акцепторному механизму. Равноценность всех связей свидетельствует о делокализации π –связи между тремя атомами фтора.
Структурную формулу молекулы BF3 с учётом делокализации π- связи можно изобразить следующими образом (нелокализованную связь обозначена пунктиром):

Рис.11 Строение молекулы BF3
Нелокализованная π-связь обусловливает нецелочисленную кратность связи. В данном случае она равна 1 1 /3 поскольку между атомом бора и каждым из атомов фтора осуществляется одна σ–связь и 1 /3часть π-связи.
Точно также равноценность всех связей в ионе NO3–свидетельствует о делокализации π –связи и отрицательного заряда на все атомы кислорода. В плоском треугольном ионе NO3-( sp2-гибридизация атома азота) делокализованные
π-связи (изображены пунктирными линиями) равномерно распределяются между всеми атомами кислорода ( рис.12 )
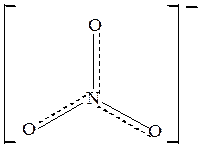
Рис. 12 Структурная формула иона NO3- с учётом делокализации π- связи
Аналогично делокализованные π-связи равномерно распределяются между всеми атомами кислорода в анионах :PO43-(sp3-гибридизация атома фосфора→тетраэдр) ,SO42-(sp3-гибридизация атома серы→тетраэдр)(рис.13)

Рис.13Структурные формулы SO42- и PO43- с учётом делокализации
π-связи.
Дата добавления: 2016-01-07; просмотров: 9522;
