Упражнения и задачи для самостоятельного решения. 1. Стандартные энтальпии образования (в кДж/моль) аммиака и нитрата аммония равны соответственно: – 46,0 и – 365,4
1. Стандартные энтальпии образования (в кДж/моль) аммиака и нитрата аммония равны соответственно: – 46,0 и – 365,4. Напишите уравнения реакций, к которым относятся эти тепловые эффекты.
2. При образовании 1,70г аммиака выделилось 4600Дж тепла. Определите стандартную теплоту образования аммиака.
Ответ: ∆Нf(NH3) = – 46,0 кДж/моль
3. Рассчитайте энтальпию реакции (при стандартных условиях):
SO2(г)+ 2H2S(г)= 3S(кр).+ 2Н2О(ж), если стандартные энтальпии образования SO2(г),H2S(г) и.H2О(ж) равны соответственно( в кДж/моль):
–297,0; –21,0; –286,0.
Ответ: ∆Нр-ции= – 233кДж
4. Окисление аммиака протекает по уравнению:
4NH3(г)+ 302(г)= 2N2(г) + 6Н2О(ж).
Стандартная энтальпия реакции равна –1532 кДж. Определите стандартную энтальпию образования аммиака, если стандартная энтальпия образования воды –286,0кДж/моль.
Ответ: ∆Нf(NH3) = –46,0 кДж/моль
5. Не производя вычислений, установите знак изменения энтропии реакции окисления аммиака (см.п.4).
6. Рассчитайте стандартную энергию Гиббса реакции:
СО(г) + Н2О(ж) = СО2(г) + Н2(г).Установите, в каком направлении эта реакция может протекать самопроизвольно в стандартных условиях при 25оС. Стандартные энергии Гиббса образования СО2(г), Н2О(ж) и СО(г) соответственное( в кДж/моль): –394,0 ; –121,0; –137.0.
Ответ:∆Goр-ции = –136 кДж
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Основные понятия и признаки химического равновесия
Большинство химических реакций является обратимыми, т.е. протекают одновременно в двух противоположных направлениях, например: N2 + 3H2 = 2NH3.
Реакция, протекающая слева направо (соединение азота с водородом), называется прямой. Реакция, протекающая справа налево (разложение аммиака), называется обратной. По истечении времени концентрации веществ, образующих данную систему, перестают меняться и остаются постоянными во времени, если не изменяются внешние условия ― установилось химическое равновесие.
Равновесное состояние— термодинамическое состояние сиcтемы, которое при постоянных внешних условиях не изменяется во времени, причём стабильность характеристик системы (состав, давление и др.) не обусловлена протеканием какого-либо внешнего процесса.
Признаки истинного равновесия системы:
1. Неизменность равновесного состояния системы при сохранении внешних условий.
2. Подвижность равновесия — самопроизвольное восстановление равновесие после прекращения внешнего воздействия.
3.Динамический характер равновесия — скорость прямого процесса равна скорости обратного процесса.
4. Состояние системы будет одинаковым независимо от того, с какой стороны она подходит к равновесию.
5. Энергия Гиббса в состоянии истинного термодинамического равновесия минимальна Gmin, a изменение энергии Гиббса равно нулю ∆G=0.
Концентрации реагентов и продуктов реакции в состоянии химического равновесия называются равновесными.
Состояние равновесной химической системы характеризуется по закону действующих масс константой равновесия.
Для обратимой химической реакцией, которую в общем виде можно изобразить уравнением aA + bB = dD + qQ константа равновесия имеет вид:
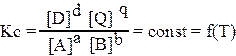
где Кс — концентрационная константа равновесия; [A], [B] — равновесные концентрации исходных веществ; [D], [Q] — равновесные концентрации продуктов реакции; a,b,d,q — стехиометрические коэффициенты.
Выражение константы равновесия показывает: для идеальных систем в состоянии химического равновесия отношение произведений концентраций продуктов реакции в степенях, равных стехиометрическим коэффициентам, к произведению концентраций исходных веществ в степенях, равных стехиометрическим коэффициентам, есть величина постоянная при данных температуре давлении и в данном растворителе.
Для реальных систем, в которых имеют место как электростатические, так и химические взаимодействия, значения концентрационных констант зависят от многих факторов. Значение концентрационной константы зависит от температуры, давления, природы растворителя и ионной силы раствора. Величина константы равновесия, выраженная через активности реагирующих частиц называется термодинамической константой равновесия.
В общем случае формулировка закона действующих масс гласит: в состоянии химического равновесия отношении произведений активностей продуктов реакции в степенях, равных стехиометрическим коэффициентам, к произведению активностей исходных веществ в степенях, равных стехиометрическим коэффициентам, есть величина постоянная при данных температуре, давлении и в данном растворителе.
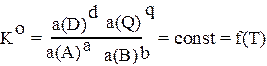
Термодинамическая константа зависит от наименьшего числа факторов и, следовательно, являются наиболее фундаментальными характеристиками равновесия. В справочниках приводятся именно термодинамические константы равновесия.
Факторы, влияющие на величину константы химического равновесия:
1. Природа реагирующих веществ
2. Температура.
Факторы, не влияющие на величину константы равновесия:
1. Концентрации реагирующих веществ
2. Давление в реакционной системе
3. Наличие примесей
Дата добавления: 2016-01-07; просмотров: 1158;
