Номенклатура и изомерия аренов
Бензол
Простейшим представителем аренов является бензол. Рассмотрим подробнее его свойства.
Физические свойства
Бензол представляет собой прозрачную бесцветную легколетучую жидкость с характерным запахом (именно по причине сильного запаха ароматические соединения получили свое название). Температура плавления 5,5°С, кипения — 80°С . Не смешивается с водой, но хорошо смешивается с большинством органических растворителей. Является растворителем для неполярных органических веществ. Горит коптящим пламенем (неполное сгорание) с образованием, кроме углекислого газа и воды, значительного количества сажи. Ядовит и как жидкость, и в виде паров при вдыхании.
Получение бензола
1. В промышленности бензол получают риформингом нефти, который по сути представляет собой дегидрогенизацию алканов нефти с образованием циклического скелета. В «чистом» виде основная реакция риформинга — это дегидрогенизация гексана:
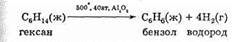
Кроме того, бензол является одним из летучих продуктов коксования. Коксование — это нагревание каменного угля до 1000°С без доступа воздуха. При этом получается также много других ценных реагентов для органического синтеза и используемый в металлургии кокс. Также бензол можно получить тримеризацией ацетилена над активированным углем при 100°С.
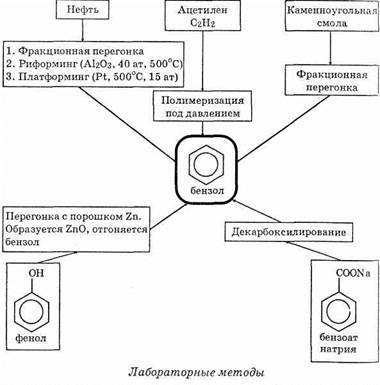
2. В лаборатории бензол, разумеется, не получают, но теоретически методы его синтеза есть (они используются для получения его производных). И промышленные, и лабораторные методы отражены на приведенной ниже схеме.
Схемаметодов получения бензола
Промышленные методы.
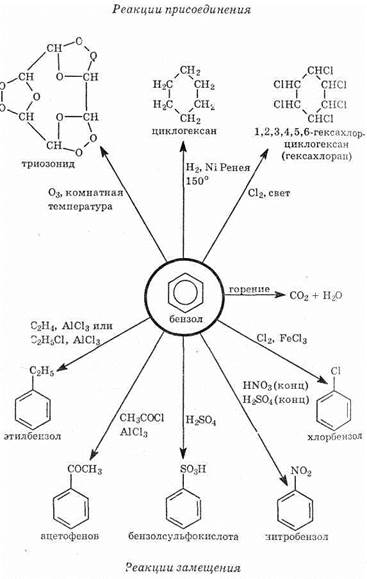
Химические свойства бензола
Химические свойства бензола определяются, безусловно, его p-системой. Так же, как и в случае алкенов, она может быть атакована электрофильной частицей. Однако в случае ароматических соединений результат такой атаки будет совершенно иным. Высокая стабильность p-системы приводит к тому, что в конце реакции она, как правило, восстанавливается и результатом реакции является не присоединение (которое бы разрушило
p-систему), а электрофильное замещение. Рассмотрим подробнее его механизм.
На первой стадии атака молекулы АВ, содержащей электрофильный центр А, приводит к образованию крайне нестабильного p-комплекса (стадия 1). При этом ароматическая система не нарушена. Далее образуется ковалентная связь одного из атомов кольца с частицей А (стадия 2). При этом, во-первых, разрывается связь А-В, а во-вторых, разрушается p-система. Образовавшаяся нестабильная положительно заряженная молекула называется s-комплексом. Как уже было сказано, восстановление p-системы энергетически весьма выгодно, и это приводит к разрыву либо связи С-А (и тогда молекула возвращается в исходное состояние), либо связи С-Н (стадия 3). В последнем случае реакция заканчивается, и получается продукт замещения водорода на А.
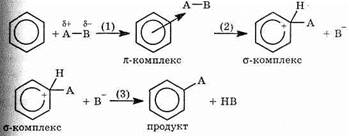
Большинство реакций ароматических соединений имеют именно такой механизм (электрофильное замещение, сокращенно SE). Рассмотрим некоторые из них.
1. Галогенирование. Происходит только в присутствии катализаторов — кислот Льюиса (см. «Теория Льюиса»). Задача катализатора — поляризация молекулы галогена для образования хорошего электрофильного центра:
| АlСl3+Сl2«Сl+[АlСl4]-Образовавшаяся частица имеет электрофильный атом хлора, и
происходит реакция:
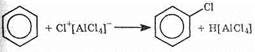
К Нитрование. Осуществляется смесью азотной и серной кислот (нитрующей смесью). В нитрующей смеси происходит реакция:
HNO3+H2SO4«NO+2[HSO-4]+Н2O
В образовавшемся гидросульфате нитрония есть мощный электрофильный центр — ион нитрония NO+2. Соответственно проходит реакция, общее уравнение которой:

3. Сульфирование. В концентрированной серной кислоте есть равновесие:
2H2SO4«SO3H+[HSO4]-+Н2O
В молекуле в правой части равновесия есть сильный электрофил SO3H+, который вступает в реакцию с бензолом. Результирующая реакция:

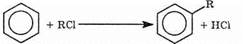
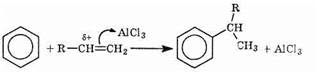
Алкилирование по Фриделю-Крафтсу. При взаимодействии бензола с алкилхлоридами или алкенами в присутствии кислот Льюиса (обычно галогенидов алюминия) получаются алкилзамещенные бензолы. В случае алкилгалогенидов первая стадия процесса:
RСl+АlСl3«R+[АlСl4]-На второй стадии электрофильная частица R+атакует p-систему:
В случае алкенов кислота Льюиса поляризует двойную связь алкена, и на углероде опять-таки образуется электрофильный центр:
К неэлектрофильным реакциям относятся:
1. Гидрирование бензола. Эта реакция идет с разрушением p-системы и требует жестких условий (высокое давление, температура, катализатор — платиновые металлы):
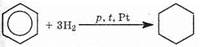
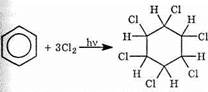
2. Радикальное хлорирование. В отсутствие кислот Льюиса и при жестком ультрафиолетовом облучении бензол может реагировать с хлором по радикальному механизму. При этом разрушается p-система и образуется продукт присоединения хлора — твердое вещество гексахлоран, которое раньше использовалось в качестве инсектицида:
Гомологи бензола
Номенклатура и изомерия аренов
Все арены условно можно разделить на два ряда. Первый ряд — производные бензола (толуол, дифенил): второй ряд — конденсированные (полиядерные) арены (нафталин, антрацен).
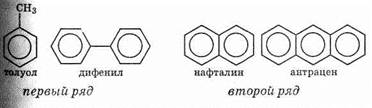
Рассмотрим гомологический ряд бензола, соединения этого ряда имеют общую формулу СnН2n.6. Структурная изомерия в гомологическом ряду бензола обусловлена взаимным расположением заместителей в ядре. Монозамещенные производные бензола Не имеют изомеров положения, так как все атомы в бензольном ядре равноценны,
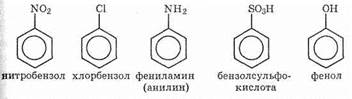
I Группа С6Н5 называется фенильной. Фенильная и замещенные фенильные группы называются арильными. Ниже показаны некоторые производные бензола:
Схема реакций бензола
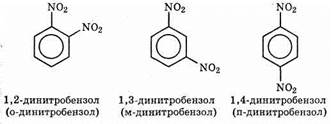
Изомеры с двумя заместителями в положениям 1,2; 1,3 и 1,4 называются орто-, мета- и пара-изомерами:
Номенклатура ароматических соединений
Ниже приведены названия некоторых ароматических соединений:
C6H5NH3+Сl- Фениламмоний хлорид (анилиний хлорид)
СбН5СO2Н Бензолкарбоновая кислота (бензойная кислота)
C6H5CO2C2H5 Этиловый эфир бензолкарбоновой кислоты (этилбензоат)
C6H5COCl Бензолкарбонилхлорид (бензоилхлорид)
C6H5CONH2 Бензолкарбоксамид (бензамид)
C6H5CN Бензолкарбонитрил (бензонитрил)
C6H5CHO Бензолкарбальдегид (бензальдегид)
C6H5COCH3 Ацетофенон
C6H5OH Фенол
C6H5NH2 Фениламин (анилин)
C6H5OCH3 Метоксибензол (анизол)
Эти названия соответствуют номенклатуре IUPAC. В скобках Указаны традиционные названия, которые по-прежнему широко распространены и вполне допустимы.
Номенклатура аренов
Название производного бензола с двумя или более заместителями в бензольном кольце строится таким образом. Атом углерода бензольного кольца, к которому присоединен заместитель, находящийся ближе других к началу приведенного выше списка, получает номер 1. Далее атомы углерода бензольного кольца нумеруются так, чтобы локант — номер второго заместителя — был наименьшим.
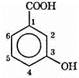
3-гидроксибензолкарбоновая кислота (3-гядроксибензойная кислота)
Карбоксильная группа рассматривается как главная группа, и ей присваивается локант «1». Нумерация кольца строится так, чтобы гидроксильная группа получила меньший («3», а не «5») локант.
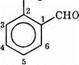
2-аминобензолкарб альдегид (2-аминобензальдегид)
Группа —CHO рассматривается как главная. Она получает локант «1». Группа—NH2 находится в положении «2», а не «6». Кроме того, допустимо название о-аминобензальдегид.
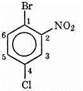
1-бром-2-нитро-4-хлорбензол Эти группы перечисляются в алфавитном порядке.
Получение аренов
Получение из алифатических углеводородов. При пропускании алканов с неразветвленной цепью, имеющих не менее 6 атомов углерода в молекуле, над нагретой платиной или оксидом хрома (III) происходит дегидроциклизация — образование арена с выделением водорода. Например:
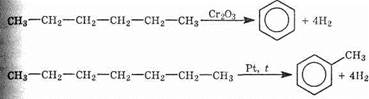
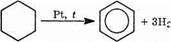
2. Дегидрирование циклоалканов. Реакция происходит при пропускании паров циклогексана и его гомологов над нагретой платиной:
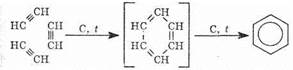
|. Получение бензола тримеризацией ацетилена. По способу Н. Д. Зелинского и Б. А. Казанского бензол можно получить, пропуская ацетилен через нагретую до 100°С трубку с активированным углем. Весь процесс можно изобразить схемой:
4. Получение гомологов бензола по реакции Фриделя-Крафтса (см. Химические свойства бензола).
5. Сплавливание солей ароматических кислот со щелочью: C6H6-COONa+NaOH ®C6H6+Na2CO3
Применение аренов
Арены применяются как химическое сырье для производства лекарств, пластмасс, красителей, ядохимикатов и многих других органических веществ. Широко используют арены как растворители.
Реакции дегидрирования позволяют использовать углеводороды нефти для получения углеводородов ряда бензола. Они указывают на связь между различными группами углеводородов и на взаимное превращение их друг в друга.
Дата добавления: 2016-01-03; просмотров: 5474;
