Физические свойства аренов
Первые члены гомологического ряда бензола (например, толуол, этилбензол и др.) — бесцветные жидкости со специфическим запахом. Они легче воды и в воде нерастворимы. Хорошо растворяются в органических растворителях. Бензол и его гомо-
логи сами являются хорошими растворителями для многих органических веществ. Все арены горят коптящим пламенем ввиду высокого содержания углерода в их молекулах.
Химические свойства гомологов бензола (аренов)
Арены имеют ряд особых химических свойств, связанных с взаимным влиянием алкильного радикала на бензольное кольцо и наоборот.
Реакции в боковой цепи
По химическим свойствам алкильные радикалы сходны с алканами. Атомы водорода в них замещаются на галоген по свободно-радикальному механизму. Поэтому под действием ультрафиолетовых лучей (без катализатора) идет реакция радикального замещения в боковой цепи. Влияние бензольного кольца на алкильные заместители приводит к тому, что замещается всегда атом водорода у атома углерода, непосредственно связанного с бензольным кольцом (a-атома углерода):
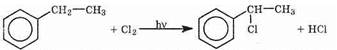
Замещение в бензольном кольце возможно только по механизму <SE в присутствии катализатора АlСl3:
С6Н5-СН3+Сl2®Сl-С6Н4-СН3+НСl
Три изомера хлортолуола образуются в результате этой реакции (см. выше).
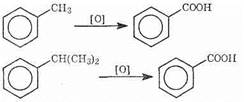
При действии на гомологи бензола перманганатом калия другими сильными окислителями боковая цепь окисляется. Какой бы сложной ни была цепь заместителя, она разрушается, за исключением a-атома углерода, который окисляется в карбоксильную группу.
Гомологи бензола с одной боковой цепью дают бензойную кислоту:
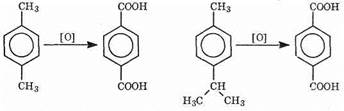
Гомологи, содержащие две боковые цепи, дают двухосновные
кислоты:
Ориентирующее действие заместителей в бензольном кольце
К реакциям электрофильного замещения способен не только бензол, но и его гомологи, а также разнообразные ароматические соединения, уже содержащие другие заместители. Примером может служить действие азотной кислоты на толуол. При этом последовательно вводятся три нитрогруппы и образуется 2,4,6-тринитротолуол:
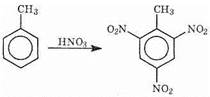
Почему же образуется именно этот изомер? Какое положение (орто-, мета- или пара-) займет, например, хлор при хлорировании нитробензола:
NO2-C6H5®Cl2 NO2-C6H4-Cl?
Ответы на эти вопросы дают правила ориентации:
1) Заместители, имеющиеся в бензольном ядре, направляют вновь вступающую группу в определенные положения, т.е. оказывают ориентирующее (направляющее) действие.
2) По своему направляющему действию все заместители делятся: — на ориентанты первого рода, направляющие вступающий
заместитель в орто- и пара-положения. Это аминогруппа
—NH2, гидроксид —ОН, алкильные группы (—СН3, —С2Н5), галогены;
— на ориентанты второго рода, направляющие вступающий заместитель в мета-положение. К ним относится нитрогруппа — NO2, сульфогруппа —SО3Н,альдегидная группа —СНО, карбоксильная группа —СООН и ее функциональные производные. Ориентанты приведены в порядке убывания своей направляющей силы.
Ориентанты первого рода (кроме галогенов), находящиеся в бензольном ядре, обладают также способностью облегчать вступление второго заместителя. Ориентанты второго рода (а также галогены, хотя они и относятся к ориентантам первого рода) затрудняют вступление второго заместителя.
Рассмотрим обоснование и применение правил ориентации на примере нитрования толуола. Метальная группа проявляет +I-эффект, т.е. обогащает бензольное ядро электронами, причем (-)-заряд оказывается в соседних с СН3-группой (т.е. орто-) положениях, так же как в пропилене (сравним с правилом Марковникова, см. §2.4), а оттуда переносится в сопряженной системе в пара-положение:
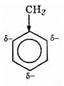
Естественно, что реагент — нитроний-катион NO+2 (электрофильная частица) — направляется в положения, обогащенные электронной плотностью, т.е. метальная группа ведет себя как орто-, пара-ориентант.
Примерно так же, используя представления о (+)- и (-) индукционных эффектах и о (+)- и (-)-мезомерных эффектах, можно объяснить ориентирующее действие других заместителей. Для более полного объяснения необходимо было бы рассмотреть и динамический фактор (как при объяснении правила Марковникова), однако это существенно усложнило бы изложение. Об этом можно узнать из курсов органической химии в высших учебных заведениях.
Используя правила ориентации, получают необходимые изомеры двух и (вообще поли-) замещенных ароматических соединений. Предположим, например, что нам нужны все три изомерных хлорнитробензола. Взяв в качестве исходного вещества хлорбензол и подвергнув его нитрованию, получим орто- и пара-изомеры:
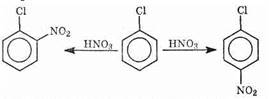
Мета-нитрохлорбензол этим путем получить нельзя. Для этого надо воспользоваться реакцией хлорирования нитробензола:
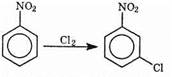
Следует иметь в виду, что правила ориентации определяют лишь главное направление реакции; обычно образуется и некоторое количество не предусмотренного правилами изомера.
Дата добавления: 2016-01-03; просмотров: 1658;
