НЕПРЕДЕЛЬНЫЕ КИСЛОТЫ
Из класса непредельных одноосновных карбоновых кислот наибольший интерес для изучения представляют акриловая и олеиновая кислоты. Первая — как первый член гомологического ряда, производные которой имеют большое значение при получении синтетических материалов. Олеиновая кислота является представителем непредельных кислот, входящих в состав жиров.
Вместо акриловой кислоты СН2=СН—СООН можно воспользоваться ее ближайшим и более доступным гомологом — метакриловой кислотой, эфиры которой применяются для получения широко известных полимерных продуктов (органического стекла).
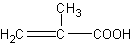
Получение метакриловой кислоты (по В.В.Некрасову). Метакриловая кислота может быть получена гидролизом сложного эфира — метилметакрилата. Метилметакрилат для этого опыта может быть в свою очередь получен деполимеризацией полиметилметакрилата (органического стекла), как это описано на с. 68. Гидролиз проводится в присутствии щелочи. Метакриловая кислота при этом образует соль, из которой она может быть выделена действием более сильной кислоты:
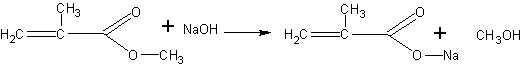
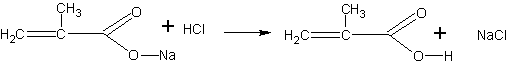
Помещают в пробирку 2 мл метилового эфира метакриловой кислоты (метилметакрилата) и 4 мл концентрированного раствора едкого натра. Чтобы смесь получилась гомогенной, добавляют 1 мл этанола и встряхивают. Через 15—20 мин переливают жидкость в фарфоровую чашку и выпаривают досуха на слабом пламени. Остаток представляет собой натриевую соль метакриловой кислоты с возможной примесью щелочи. Дальнейшая задача сводится к выделению кислоты из соли. Для этого сухой остаток переносят в пробирку и, охлаждая ее водой, добавляют несколько миллилитров концентрированной соляной кислоты (до кислой реакции на индикатор). После отстаивания смеси метакриловая кислота собирается сверху в виде маслянистой жидкости с характерным запахом. Кислоту переносят при помощи пипетки в другую пробирку.
Свойства метакриловой кислоты. Метакриловая кислота, будучи соединением непредельным, реагирует с бромной водой, перманганатом калия и легко полимеризуется.
а) К небольшому количеству (нескольким каплям) метакриловой кислоты приливают бромную воду и смесь встряхивают. Бромная вода обесцвечивается вследствие присоединения брома по месту двойной связи. Учащиеся составляют уравнение реакции.
Подобным образом проводится опыт с водным раствором пер-манганата калия.
б) К небольшому количеству метакриловой кислоты добавляют несколько крупинок перекиси бензоила в качестве инициатора реакции и нагревают до начала кипения. Кислота быстро полимеризуется.
Непредельность олеиновой кислоты. Олеиновая кислота является единственным представителем класса непредельных кислот, входящих в состав жиров и изучаемых в школьном курсе химии. Непредельность ее может быть проиллюстрирована действием обычных реактивов на двойную связь: бромной воды и раствора перманганата калия.
К 5—8 мл олеиновой кислоты в пробирке или колбочке приливают равный объем бромной воды или раствора перманганата калия и встряхивают. Окраска брома и перманганата калия исчезает вследствие присоединения по месту двойной связи.
ЩАВЕЛЕВАЯ КИСЛОТА
Наибольшее значение в этом разделе имеют опыты, связанные со строением щавелевой кислоты и ее двухосновностью.
Получение щавелевой кислоты из муравьиной. Первым подтверждением структурной формулы щавелевой кислоты может служить получение ее солей из солей муравьиной кислоты.
Формиат натрия при нагревании выделяет водород; одновременно образуется оксалат натрия

Очевидно, что из молекулы соли при этом уходит единственный атом водорода. А так как радикалы неспособны к сколько-нибудь длительному существованию, то они рекомбинируются, образуя молекулы новой соли, которой отвечает кислота

В пробирке, закрытой пробкой с вертикальной трубкой, нагревают в пламени горелки сухой формиат натрия.
Соль плавится и затем (при сильном нагревании) разлагается. Устанавливают выделение водорода, собирая его в пробирку или поджигая через некоторое время у отводной трубки.
Разложение щавелевой кислоты при нагревании с серной кислотой. Если щавелевая кислота имеет формулу

то можно предположить, что при отнятии от нее элементов воды должны выделяться углекислый газ и оксид углерода (II). Этот факт послужил бы подтверждением структурной формулы кислоты.
Учащимся можно предложить самим придумать прибор, в котором следовало бы провести эту реакцию так, чтобы обнаружить оба образующихся газа.
Опыт может быть осуществлен, например, в приборе, изображенном на рис. 32.
В небольшую колбочку помещают 2—3 г щавелевой кислоты и двойной объем концентрированной серной кислоты. В пробирку с отводной трубкой наливают известковую воду. При нагревании смеси кислот на горелке известковая вода мутится. Когда можно будет предположить, что воздух вытеснен из прибора, поджигают у отводной трубки пробирки оксид углерода (II), который горит характерным синим пламенем.
 Учащимся можно предложить разработать количественное проведение этого опыта, и в частности определить объемное соотношение образующихся газов. Некоторые указания к конструированию прибора им даст описание опыта разложения уксусной кислоты на углекислый газ и метан (с. 115). При этом в качестве обязательного требования необходимо поставить достижение максимальной простоты прибора.
Учащимся можно предложить разработать количественное проведение этого опыта, и в частности определить объемное соотношение образующихся газов. Некоторые указания к конструированию прибора им даст описание опыта разложения уксусной кислоты на углекислый газ и метан (с. 115). При этом в качестве обязательного требования необходимо поставить достижение максимальной простоты прибора.
Окисление щавелевой кислоты. Щавелевая кислота окисляется легче уксусной. Распадаясь на воду, углекислый газ и оксид углерода (II), она, очевидно, нуждается в незначительном количестве кислорода, чтобы дать конечные продукты окисления — углекислый газ и воду. Для простоты можно считать, что действие окислителя сводится к превращению угарного газа в углекислый.
В качестве окислителя может быть взят не раз применявшийся в подобных случаях перманганат калия с серной кислотой.
В небольшую колбочку с отводной трубкой наливают 5 мл концентрированного раствора щавелевой кислоты и равный объем разбавленной серной кислоты (1 : 5).
Из капельной воронки в колбу приливают постепенно 10 мл не слишком слабого раствора перманганата калия. При нагревании колбы фиолетовая окраска быстро исчезает и наблюдается энергичное выделение углекислого газа. Его пропускают в известковую или баритовую воду или же собирают в цилиндр и затем испытывают соответствующим способом. Уравнение реакции можно представить следующим образом:
5Н2С2O4 + 2KMnO4 + 3H2SO4 à 10СО2 + K2SO4 + 2MnSO4 + 8Н2O
Образование кислых и средних солей щавелевой кислоты. В молекуле щавелевой кислоты имеются две карбоксильные группы, следовательно, щавелевая кислота двухосновная.
Как кислота двухосновная, щавелевая кислота может давать соли кислые и средние. Это может быть показано на реакции нейтрализации.
Растворяют 12 г щавелевой кислоты примерно в 20 мл воды и делят раствор пополам. К одной части раствора приливают понемногу концентрированный раствор гидроксида калия. Наблюдают, что сначала образуется осадок, который при дальнейшем прибавлении щелочи растворяется. Очевидно, что сначала получается кислая соль (гидрооксалат калия), нерастворимая в воде. В дальнейшем, при добавлении щелочи, эта соль превратилась в среднюю, растворимую в воде:

Если теперь к раствору средней соли прилить вторую порцию щавелевой кислоты, то снова образуется обильный осадок гидрооксалата калия:
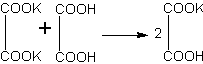
БЕНЗОЙНАЯ КИСЛОТА
Изучение бензойной кислоты на уроке не входит в программу по химии. Учителя иногда посвящают несколько минут ознакомлению с нею лишь для того, чтобы показать, как образуются кислоты в ароматическом ряду и что они собой представляют. Если ранее ставился опыт окисления бензальдегида в бензойную кислоту, здесь можно познакомить учащихся лишь с физическими свойствами ее.
Растворимость бензойной кислоты в воде. Встряхивая в пробирке очень небольшое количество кристаллов бензойной кислоты с водой, убеждаются, что заметного растворения не происходит. При нагревании пробирки происходит растворение кислоты, а при охлаждении она вновь кристаллизуется. Убеждаются, что водный раствор бензойной кислоты окрашивает лакмус в красный цвет.
Растворимость бензойной кислоты в щелочах. К небольшому количеству бензойной кислоты в пробирке прибавляют воду. Убедившись, что кислота не растворяется, добавляют по каплям крепкий раствор щелочи, пока кислота не растворится. После этого подкисляют раствор соляной кислотой. Выделяются мелкие кристаллы бензойной кислоты:
С6Н5СООН + NaOH à C6H5COONa + НСI+ H2O
C6H5COONa + НСI à С6Н5СООН + NaCl

Возгонка бензойной кислоты. Собирают прибор из двух пробирок разной величины, как показано на рис. 33. В большую пробирку на дно насыпают бензойную кислоту, а маленькая пробирка наполнена холодной водой. При нагревании прибора на пламени горелки бензойная кислота возгоняется и осаждается в виде белых кристаллов на пробирке-холодильнике.
С помощью бензойной кислоты учащимися может быть осуществлена имитация «зимнего пейзажа».
На картоне (с отверстиями) или на листе пористой (фильтровальной) бумаги монтируют небольшой макет сада. Под картоном (бумагой) нагревают в фарфоровой или железной чашке бензойную кислоту, накрыв всю установку стеклянным колпаком. Возгоняющаяся кислота, проходя через отверстия в картоне или поры в бумаге, осаждается на «деревьях» в виде красивого инея. Следует остерегаться попадания паров бензойной кислоты в атмосферу.
Получение бензойной кислоты окислением бензальдегида. Бензальдегид легко окисляется в бензойную кислоту кислородом воздуха.
На стеклянную пластинку, часовое стекло или в фарфоровую чашку помещают несколько капель бензальдегида. Через несколько минут начинают появляться кристаллы. К концу урока весь альдегид превращается в кислоту.
Взяв для опыта несколько миллилитров альдегида, таким способом можно получить бензойную кислоту в количестве, необходимом для демонстрации опытов с ней.
Получение бензола из бензойной кислоты (см. опыт на с. 63).
Дата добавления: 2016-01-03; просмотров: 5774;
