Спирт — растворитель. 3 страница
в) Действие аммиака в качестве катализатора можно проследить на следующем опыте, который можно поставить и в несколько укрупненном масштабе.
В большую пробирку насыпают 4—5 г фенола, приливают 10 мл 40-процентного формалина и 1—2 мл концентрированного раствора аммиака. Смесь нагревают в течение нескольких минут в пламени горелки. После того как смесь вскипит (бурная реакция) и затем сделается мутной вследствие образования смолы, охлаждают пробирку и дают жидкости расслоиться. Сливают верхний водный слой и демонстрируют в пробирке вязкую жидкость — фенолформальдегидную смолу. Затем смолу помещают в пробирке или в какой-нибудь формочке в сушильный шкаф, Через час-полтора (иногда раньше) смола превращается в твердую пластмассу. Так очень упрощенно может быть имитировано производство литых изделий из смолы.
г) Действие щелочного и кислотного катализатора на процесс поликонденсации можно показать одновременно. В две пробирки помешают по 2,5 г фенола и по 5 мл формалина. Затем в одну пробирку приливают 1 мл концентрированного раствора аммиака, а в другую — 7—8 капель соляной кислоты. Пробирки помешают в кипящую водяную баню. Через 5—10 мин в пробирках образуется смола. Сливают после отстаивания верхний водный слой и затем выливают смолу на листы картона или жести.
д) В химическом кружке учащиеся могут получить фенолфор-
мальдегидную смолу в большем количестве и с более тщательным соблюдением режима.
В круглодонную колбу с обратным холодильником помещают 25 г фенола, 50 мл формалина и 3 мл 40-процентного раствора едкого натра. Осторожно нагревают смесь через асбестированную сетку. Нагрев регулируют так, чтобы жидкость не кипела слишком бурно. По мере нагревания жидкость становится все более вязкой и примерно через час настолько густеет, что пузырьки газа с трудом вырываются на поверхность. Выливают жидкость в пробирку, При охлаждении она образует непрозрачную твердую массу. Чтобы довести процесс поликонденсации до образования трехмерной структуры, пробирку помещают в сушильный шкаф, где выдерживают продукт 1 ч при 50— 60°С и 3—4 ч при 70— 80°С. Образуется твердая нерастворимая смола ярко-розового цвета.
УКСУСНЫЙ АЛЬДЕГИД (ЭТАНАЛЬ)
После подробного ознакомления со свойствами формальдегида в данном разделе темы наибольшее значение приобретают опыты, связанные с получением уксусного альдегида. Эти опыты могут ставиться с целью: а) показать, что все альдегиды могут быть получены окислением соответствующих одноатомных спиртов, б) показать, как экспериментальным путем может быть обоснована структура альдегидов, в) познакомить с химизмом промышленного способа получения уксусного альдегида по Кучсрову.
Получение уксусного альдегида окислением этанола. В качестве окислителя спирта может быть взят оксид меди (II). Реакция идет аналогично окислению метанола:
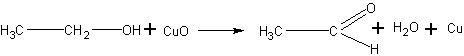
1. В пробирку наливают не более 0,5 мл этилового спирта и погружают раскаленную медную проволочку. Обнаруживают запах уксусного альдегида, напоминающий запах фруктов, и наблюдают восстановление меди. Если окисление спирта произвести 2-3 раза, всякий раз накаливая медь до образования оксида меди, то, собрав растворы, полученные учащимися в пробирках, можно будет использовать альдегид для опытов с ним.
2. В небольшую колбочку с отводной трубкой помещают 5 г измельченного бихромата калия К2Сг2О7, наливают 20 мл разбавленной серной кислоты (1:5) и затем 4 мл этилового спирта. К колбе присоединяют холодильник и нагревают ее на небольшом пламени через асбестированную сетку. Приемник для дистиллята ста-
вят в ледяную воду или снег. В приемник наливают немного воды и в воду опускают конец холодильника. Это делается для того, чтобы уменьшить улетучивание паров уксусного альдегида (темп. кип. 21 °С). Вместе с этаналем в приемник отгоняется некоторое количество воды, не прореагировавшего спирта, образующейся уксусной кислоты и других побочных продуктов реакции. Однако выделять чистый уксусный альдегид нет необходимости, так как полученный продукт хорошо дает обычные реакции альдегидов. Наличие альдегида устанавливают по запаху и по реакции серебряного зеркала.
Внимание учащихся обращают на изменение окраски в колбе. Зеленая окраска получившегося сульфата хрома (III) Cr2(SO4)3 становится особенно отчетливой, если содержимое колбы после опыта разбавить водой. Отмечают, что изменение окраски бихромата калия произошло вследствие окисления им спирта.
Получение уксусного альдегида гидратацией ацетилена. Замечательное открытие русского химика М.Г.Кучерова — присоединение воды к ацетилену в присутствии солей ртути легло в основу широко распространенного промышленного способа получения уксусного альдегида.

Несмотря на большое значение и доступность для школы, этот способ редко демонстрируется на уроках химии.
В промышленности процесс ведут, пропуская ацетилен в воду, содержащую соли двухвалентной ртути и серную кислоту, при температуре 70°С. Образующийся ацетальдегид при этих условиях отгоняется и конденсируется, после чего поступает в специальные башни для окисления в уксусную кислоту. Ацетилен получают из карбида кальция обычным путем и очищают его от примесей.
Необходимость очистки ацетилена и поддержания температуры в реакционном сосуде, с одной стороны, и неуверенность в получении нужного продукта — с другой, обычно снижают интерес к этому опыту. Между тем опыт можно достаточно просто и надежно провести как в упрощенном виде, так и в условиях, приближающихся к промышленным.
1. Опыт, в определенной степени отражающий условия проведения реакции на производстве и дающий возможность получить достаточно концентрированный раствор альдегида, можно провести в приборе, изображенном на рис. 29.
Первый этап — получение ацетилена. В колбу помещают кусочки карбида кальция и из капельной воронки медленно прибав-

ляют воду или насыщенный раствор поваренной соли. Скорость прикалывания регулируют таким образом, чтобы установился ровный ток ацетилена приблизительно один пузырек в 1—2 с. Очистку ацетилена производят в промывалке с раствором сульфата меди:
CuSО4 + H2S àH2SO4
После очистки газ пропускают в колбу с раствором катализатора (15—20 мл воды, 6—7 мл конц. серной кислоты и около 0,5 г оксида ртути (II). Колбу, где проходит гидратация ацетилена, подогревают горелкой (спиртовкой), а образующийся уксусный альдегид в газообразном виде попадает в пробирки с водой, где и происходит его поглощение.
Минут через 5—7 в пробирке удается получить раствор этаналя значительной концентрации. Чтобы завершить опыт, сначала прекращают подачу воды к карбиду кальция, затем разъединяют прибор и без всякой дополнительной отгонки альдегида из реакционной колбы пользуются полученными растворами в пробирках для соответствующих опытов.
2. В самом упрощенном виде реакция М.Г.Кучерова может быть осуществлена следующим образом.
В небольшую круглодонную колбу наливают 30 мл воды и 15 мл конц. серной кислоты. Смесь охлаждают и вносят в нее немного (на кончике шпателя) оксида ртути (II). Нагревают смесь осторожно через асбестовую сетку до кипения, оксид ртути при этом превращается в сульфат ртути (II). Помещают в колбочку 4—5 кусоч-
ков карбида кальция, немедленно закрывают ее пробкой с газоотводной трубкой, конец которой опускают в пробирку с водой. Пробирку-приемник помещают в стакан со снегом или в охлаждающую смесь. Реакция карбида кальция с водой в присутствии серной кислоты протекает довольно спокойно. Продолжают слабое нагревание смеси в течение 10-12 мин. Уксусный альдегид перегоняется в пробирку-приемник и растворяется в воде. Присутствие альдегида в растворе можно обнаружить по запаху и по появлению розовой окраски фуксинсернистой кислоты. Реакции с аммиачным раствором оксида серебра и гидроксидом меди вследствие наличия примесей идут менее характерно.
БЕНЗОЙНЫЙ АЛЬДЕГИД
С бензальдегидом учащихся можно ознакомить кратко. Главная цель, которая преследуется здесь, — показать, что альдегиды существуют среди соединений не только жирного, но и ароматического ряда органических соединений.
Поэтому будет вполне достаточно ознакомить учащихся на опыте с характерным запахом а/тьдегида (что связано с практическим его использованием), с реакцией серебряного зеркала (что устанавливает принадлежность его к классу альдегидов) и с окислением кислородом воздуха (что наиболее убедительно показывает превращение альдегидов в кислоты).
Запах бензальдегида и окисление кислородом воздуха. Одновременно с тем, как учитель начинает излагать сведения о бензальдегиде, на ученические столы выдают часовые стекла или стеклянные пластинки, на которых нанесено по нескольку капель бензальдегида. Учащиеся знакомятся с запахом вещества. После того как объяснен дальнейший материал и продемонстрирована реакция серебряного зеркала с бензальдегидом (см. ниже), учитель сообщает, что бензойную кислоту, которую не пришлось наблюдать в проведенной реакции, .можно видеть на выданных пластинках с бензальдегидом. К этому времени на стеклах начинают появляться красивые кристаллы бензойной кислоты (для этого необходимо 10—15 мин). К следующему уроку весь альдегид превращается в кристаллы. Учащиеся составляют соответствующее уравнение реакции:
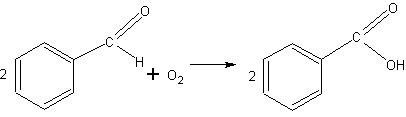
Реакция серебряного зеркала. Реакцию проводят совершенно так-
же, как с другими альдегидами. К 5—8 мл аммиачного раствора оксида серебра в чистой пробирке прибавляют 2—3 капли бензальдегида и нагревают смесь в горячей воде или осторожно над небольшим пламенем спиртовки. Образуются бензойная кислота и серебро.
АЦЕТОН (ДИМЕТИЛПРОПАНОН)
Школьной программой не предусматривается изучение кетонов. Однако некоторые учителя знакомят учащихся на уроках или в процессе внеклассной работы с окислением вторичных спиртов и практически наиболее важным представителем класса кетонов — ацетоном. Ниже приводятся опыты, которые могут быть использованы с этой целью.
Горение ацетона. Несколько капель ацетона наливают на крышку фарфорового тигля и поджигают. Ацетон горит слабо светящимся пламенем.
Растворимость ацетона в воде. К 2 мл воды добавляют равный объем ацетона. По встряхивании не удается установить расслоения жидкостей. Ацетон растворяется в воде.
Ацетон как растворитель смол и пластмасс. На этом свойстве ацетона основано его применение для изготовления лаков и для склеивания изделий из пластмасс.
а) В нескольких миллилитрах ацетона в пробирке растворяют при помешивании стеклянной палочкой столько целлулоида, чтобы раствор стал слегка вязким. Смачивают полученным лаком вату и натирают ею гладкий кусочек дерева — после улетучивания растворителя предмет оказывается «лакированным».
б) Два кусочка очищенной кинопленки или органического стекла (плексигласа) смачивают с концов ацетоном.
Через 1—2 мин накладывают концы пленки друг на друга и слегка сдавливают. После высыхания кусочки оказывают прочно склеенными ацетоном.
Отношение к аммиачному раствору оксида серебра. В две пробирки наливают одинаковые количества аммиачного раствора оксида серебра. В одну пробирку прибавляют раствор альдегида, в другую — такой же объем ацетона. Пробирки помещают одновременно в стакан с горячей водой. В пробирке с альдегидом появляется зеркало в пробирке с ацетоном восстановления серебра и, следовательно, окисления кетона не происходит.
Окисление ацетона. Ацетон не может быть окислен окисью серебра (см. предыдущий опыт), но он может быть окислен более энергичными окислителями.
Около 1 мл ацетона разбавляют в пробирке водой, приливают
серной кислоты, подогревают и вносят небольшими порциями измельченный перманганат калия, пока не перестанет исчезать его фиолетовая окраска. При нагревании раствора можно обнаружить по запаху пары уксусной кислоты.
При окислении происходит разрыв углеродной цепи и образование двух кислот — уксусной и муравьиной:
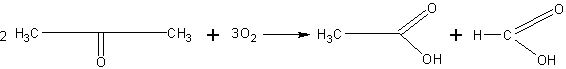
Получение бромацетона. Учащимся можно показать, что углеводородные радикалы кислородсодержащих органических веществ сохраняют в основном свойства углеводородов. Примером тому оказывается реакция бромирования ацетона:
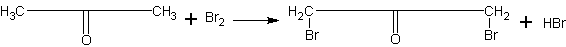
Реакция ацетона с бромом, кроме того, дает возможность довольно просто и в безопасной форме ознакомить учащихся с получением одного из слезоточивых веществ (лакриматоров). В настоящее время известны вещества, значительно превосходящие бромацетон по слезоточивому действию. Однако, принимая во внимание, что задача сводится к ознакомлению не с силой, а с характером действия вещества, целесообразно ограничиваться в указанных целях именно этим примером.
В вытяжном шкафу наливают в пробирку 1 мл ацетона и вносят несколько капель брома. Уже без подогрева обычно начинает ощущаться острый запах бромацетона. Если реакция не наступает, пробирку слегка подогревают (осторожно, беречь глаза!). Смачивают жидкостью из пробирки несколько полосок фильтровальной бумаги и раздают их на стеклышках учащимся или же помещают несколько капель жидкости на железную пластинку и нагревают ее над пламенем спиртовки.
Как только действие бромацетона на глаза обнаружено, хотя бы и в слабой форме, демонстрацию его прекращают и проветривают помещение.
Уравнение реакции учащиеся смогут составить сами, если им указать, что здесь в каждой молекуле ацетона замещается бромом один атом водорода.
В качестве наиболее сильного слезоточивого вещества указывается хлорацетофенон
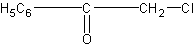
раздражающей концентрацией которого в воздухе считается 0,0003 мг/л.
Получение ацетона. В случае отсутствия в школьной лаборатории ацетон может быть получен для демонстрационных целей из солей уксусной кислоты, например, по реакции:
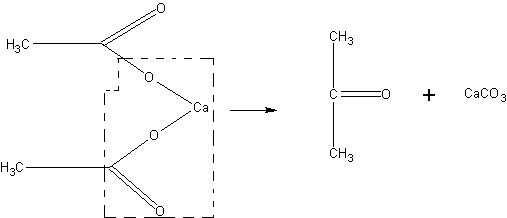
В наиболее простом виде опыт может быть проведен без выделения образующегося продукта.
В пробирке накаливают 2—3 г безводного ацетата натрия CH3COONa. Через 3—5 мин ощущается запах ацетона. Пары его при поджигании горят. По охлаждении пробирки с помощью соляной кислоты можно констатировать образование карбоната:
2CH3COONa à СН3 - СО - СН3 + Na2CO3
Na2CO3 + 2НС! à 2NaCl + Н2О + СО2
ГЛАВА VII
КАРБОНОВЫЕКИСЛОТЫ
Изучение предельных одноосновных кислот лучше всего начинать со второго члена гомологического ряда — с уксусной кислоты. Эта кислота частично уже известна учащимся, она доступна для школы, на ней более характерно проявляется структура карбоновых кислот. Муравьиная кислота как первый член ряда имеет некоторые особенности в строении и свойствах, а поэтому менее удобна для первоначального ознакомления с классом кислот.
В ряду одноосновных кислот вслед за уксусной и муравьиной рекомендуется рассмотреть также высшие гомологи кислот. Это позволит создать у учащихся более полную картину о гомологическом ряде и не возвращаться к этим кислотам в последующей теме при изучении жиров.
Химические свойства кислот в настоящей главе приводятся не полностью. С целью избежать повторения реакции кислот со спиртами описываются в следующей главе, где они являются специальным предметом рассмотрения.
УКСУСНАЯ КИСЛОТА
Учащимся знаком запах уксусной кислоты, они имеют представление о некоторых химических свойствах ее, поскольку эти свойства являются общими со свойствами неорганических кислот, знают структурную формулу кислоты. Поэтому не особенно существенно, какой порядок ознакомления с веществом будет принят. Если учитель сочтет необходимым уделить внимание обоснованию структурной формулы кислоты, то после рассмотрения физических свойств можно перейти к химическим свойствам, так как именно они дадут ответ на интересующий вопрос, и лишь затем рассмотреть способы получения.
Напротив, если учитель хочет подчеркнуть генетическую связь между органическими веществами различных классов, он предпочтет сначала рассмотреть способы получения кислот, особенно путем окисления спиртов и альдегидов, а затем перейдет к изучению химических свойств.
Кристаллизация уксусной кислоты. В демонстрационном опыте трудно показать, что чистая уксусная кислота кристаллизуется при + 16,7°С. Легче показать лишь сам факт «замерзания» ее при охлаждении. Наблюдение кристаллов объяснит учащимся, почему чистая уксусная кислота носит название ледяной.
1. В пробирку наливают несколько миллилитров уксусной кислоты (по возможности безводной) и помещают пробирку в ледяную воду. Вскоре при встряхивании наблюдают образование крупных блестящих кристаллов кислоты, напоминающих замерзшую воду. Если кислота не безводна, то она может не закристаллизоваться, в таком случае лучше пользоваться охладительной смесью снега с поваренной солью.
2. Вымораживанием кислоты из водного раствора легко получить чистую ледяную уксусную кислоту, которую можно хранить в качестве демонстрационного препарата. В небольшую колбочку наливают концентрированную уксусную кислоту и охлаждают в смеси снега с солью. Когда значительная часть жидкости закристаллизуется, выливают из колбы остаток жидкости — воду с некоторым количеством уксусной кислоты. Дают растаять замерзшей кислоте и снова помещают колбу в охладительную смесь. Когда часть жидкости снова закристаллизуется, опять сливают жидкость с кристаллов и повто-
ряют всю операцию еще раз. Так удается получить практически безводную уксусную кислоту, которую при понижении температуры очень легко переводить в кристаллическое состояние.
Горение уксусной кислоты. Проводя ряд аналогий между уксусной кислотой и минеральными кислотами, следует всякий раз подчеркивать особенность уксусной кислоты как кислоты органической, например ее горючесть.
Наливают в пробирку немного уксусной кислоты и нагревают в пламени горелки. При 118°С кислота кипит. Продолжая нагревание, поджигают пары лучинкой. Они горят слабо светящим пламенем. Учащиеся составляют уравнение реакции горения (в продуктах горения углекислый раз и вода) и дают объяснение слабой светимости пламени.
Отношение уксусной кислоты к окислителям. Легко показать, что, в отличие от спиртов и особенно альдегидов, уксусная кислота более устойчива по отношению к окислителям.
К разбавленному водному раствору чистой уксусной кислоты в химическом стакане прибавляют раствор перманганата калия и серной кислоты. Фиолетовая окраска раствора не исчезает.
Однако было бы неверным сделать заключение о неокисляемо-сти уксусной кислоты. Учащиеся уже знакомы с полным окислением кислоты при горении.
Действие уксусной кислоты на индикаторы. К растворам лакмуса и метилоранжа в демонстрационных пробирках или стаканчиках приливают немного раствора уксусной кислоты. Лакмус краснеет, метилоранж принимает розовую окраску (белый экран!).
Взаимодействие кислоты с металлами. В три пробирки наливают равные количества раствора уксусной кислоты. В одну пробирку помещают стружки магния, в другую — мелкие кусочки цинка, в третью — кусочки железной или медной проволоки. В первой пробирке наблюдают довольно энергичную реакцию. Убеждаются в том, что выделяющийся газ — водород, для чего пробирку закрывают пробкой с вертикальной трубочкой, собирают газ в перевернутую пробирку и поджигают его. Во второй пробирке реакция идет медленно и требует подогрев. Реакция с медью не идет даже при сильном нагревании.
Взаимодействие с основаниями. К очень разбавленному раствору щелочи, подкрашенному фенолфталеином, добавляют понемногу раствор уксусной кислоты, пока не обесцветится фенолфталеин. Составляют уравнение соответствующей реакции.
Аналогичный опыт может быть показан с гидроксидом кальция, взмученным в воде. При добавлении уксусной кислоты раствор становится прозрачным (ацетат кальция растворим в воде).
Взаимодействие с солями. Для опыта следует воспользоваться солью кислоты более слабой, чем уксусная, чтобы показать течение реакции до конца и образование соли уксусной кислоты. Наиболее удобны для этой цели карбонаты.
В маленькую колбу с отводной трубкой помещают 1—2 г поташа, соды или толченого мела и приливают 4—5 мл раствора уксусной кислоты. Колбочку закрывают пробкой и отводную трубку погружают в стакан с известковой водой. Известковая вода мутится от углекислого газа. Немного получившегося раствора можно выпарить на часовом стекле, чтобы наблюдать образование соли уксусной кислоты.
Уксусная кислота — кислота слабая. Чтобы показать учащимся, что уксусная кислота имеет небольшую степень диссоциации и является кислотой слабой, необходимо наряду с демонстрацией обычного опыта электропроводности ее поставить опыты, позволяющие провести хотя бы качественное сравнение скорости реакций уксусной кислоты и минеральных кислот.
а) В три пробирки помещают кусочки цинка и приливают равные количества соляной, серной и уксусной кислот (одинаковой концентрации). Замечают, что с уксусной кислотой реакция идет очень плохо или идет только при нагревании.
б) В три демонстрационные пробирки насыпают равные количества карбоната меди и прибавляют равные количества растворов соляной, серной и уксусной кислот одинаковой концентрации. Замечают, что в последнем случае скорость реакции наименьшая.
в) Если учащиеся знакомы с гидролизом солей, то можно показать гидролиз ацетата натрия и ацетата железа.
Последний опыт одновременно знакомит учащихся с характерной цветной реакцией уксусной кислоты.
К разбавленному раствору ацетата натрия приливают несколько капель фенолфталеина, и раствор разливают в две пробирки. Раствор в одной пробирке нагревают. Незначительное вначале порозовение фенолфталеина становится совершенно отчетливым при нагревании, так как гидролиз при этом усиливается:
CH3COONa + Н2O ó СН3СООН + NaOH
Поскольку водный раствор соли имеет щелочную реакцию, значит, уксусная кислота — кислота слабая.
Разбавленный раствор уксусной кислоты в стакане нейтрализуют постепенно щелочью в присутствии фенолфталеина или берут ранее полученный продукт нейтрализации. К раствору прибавляют несколько капель раствора хлорида железа FeCl3. Наблюдается характерное темно-красное окрашивание вследствие образования
ацетата железа Fe (III). При кипячении раствора образуется обильный красно-бурый осадок основного ацетата железа Fe(OH)2CH3COO. Гидролиз в этом случае проходит в значительной степени, так как соль образована слабым основанием и сравнительно слабой кислотой.
Основность уксусной кислоты. Хотя учащимся известны молекулярная и структурная формулы кислоты, можно экспериментально показать, что уксусная кислота одноосновна. Тогда станет совершенно очевидным различие в свойствах атомов водорода в молекуле кислоты.
Одноосновность кислоты легко показать, демонстрируя реакцию нейтрализации с применением молярных растворов.
Молярные растворы можно приготовить, например, из расчета 4 г едкого натра в 100 мл раствора и 6 г уксусной кислоты в 100 мл раствора. Отмеряют в коническую колбочку 10 мл молярного раствора кислоты, добавляют 2—3 капли фенолфталеина и прибавляют постепенно молярный раствор щелочи из другой бюретки до тех пор, пока появляющаяся розовая окраска не будет исчезать при взбалтывании жидкости, т.е. на каждую молекулу кислоты потребовалась одна, а не две и не три молекулы щелочи. Это значит, что уксусная кислота одноосновна.
Количественное получение метана из солей уксусной кислоты. Соли уксусной кислоты при нагревании со щелочью образуют метан (с. 27). Количественное проведение опыта дает возможность сделать заключение о структурной формуле кислоты.
Исследование продуктов реакции и сопоставление количества вступившей в реакцию соли с количеством образующегося метана позволяют сделают заключение о том, что реакция выражается уравнением:
CH3COONa + NaOH à СН4 + Na2CO3
На основании этого ведутся рассуждения о возможной структуре соли и, следовательно, кислоты.
Собирают прибор, как показано на рис. 30. В небольшую колбу или пробирку (желательно из тугоплавкого стекла) помещают хорошо перемешанную смесь порошков свежеприготовленного безводного ацетата натрия и натронной извести в весовом отношении 1 : 4 (например, 2 и 8 г или 3 и 12 г). Избыток извести необходим, чтобы обеспечить полное использование соли. Двугорлую склянку-газометр заполняют насыщенным раствором поваренной соли. Прибор проверяют на герметичность.
Смесь нагревают на газовой горелке. Нагревание должно быть равномерным и достаточно интенсивным. После того как объем
метана перестанет увеличиваться, нагревание прекращают и дают пробирке остыть. Некоторое количество раствора хлорида натрия при этом переходит обратно в склянку. Установив уровни жидкости в стакане и склянке на одной линии, определяют объем газа в склянке или объем жидкости в стакане.
Отделив газометр от пробирки, можно вытеснить из него часть газа (поднимая стакан с водой) и подтвердить, что этот газ — метан. Вычислив количество вещества исходной соли и количество вещества образующегося метана (н.у.), делают вывод, что из одного моля ацетата натрия получается один моль метана. Получающиеся отклонения из-за неполноты протекания реакции и образования побочных продуктов незначительны и совершенно не дают повода сделать какое-либо другое заключение (например, о том, что из одного моля соли образуется два моля метана).
Чтобы установить природу твердого продукта реакции, в пробирку добавляют немного соляной кислоты, закрывают пробкой и отводную трубку погружают в известковую воду. По помутнению известковой воды устанавливают, что при реакции образовался карбонат. Очевидно, что это карбонат натрия.

Рис. 30. Количественный опыт получения метана при взаимодействии ацетата натрия с натронной известью
Опыт дает надежные результаты в том случае, если исходные вещества будут тщательно подготовлены, хорошо перемешаны и будет обеспечено достаточное нагревание.
Получение кислоты окислением этанола. Альдегиды, как известно учащимся, легко окисляются в кислоты. Поэтому окисление спиртов в альдегиды можно поставить так, что образующийся альдегид, не успев удалиться из сферы реакции, тут же окислится далее в кислоту:
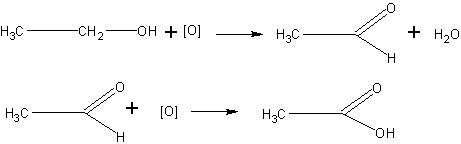
В качестве окислителя может быть использована хромовая смесь. Чтобы эта смесь могла окислить спирт в кислоту, реакцию проводят в условиях большей концентрации окислителя: берут больше бихромата, чем при получении альдегида, а спирт приливают к окислительной смеси постепенно, по мере отгонки образующейся кислоты.
Когда эти особенности получения кислоты обсуждены с учащимися, им становится понятным весь последующий опыт и одновременно закрепляются в памяти условия получения альдегидов из спиртов.
В колбочку с отводной трубкой (рис. 31) помещают 5 г измельченного бихромата калия К2Сг2О7 и 5 мл концентрированной серной кислоты. Из капельной воронки прибавляют по каплям водный раствор этанола (2 мл спирта на 8 мл воды) и отгоняют образующуюся уксусную кислоту. В приемнике собирается несколько миллилитров водного раствора уксусной кислоты с примесью альдегида и сложного эфира. Учащиеся должны дать объяснение изменению окраски раствора в колбе.

По запаху убеждаются в получении кислоты. Наблюдают образование водорода при действии на кислоту магния. Если учащиеся были знакомы также с цветной реакцией уксусной кислоты, то
нейтрализуют часть дистиллята содой (реакция не должна быть кислой) и добавляют несколько капель раствора хлорида железа (III). Темно-красное окрашивание раствора свидетельствует о наличии уксусной кислоты.
Дата добавления: 2016-01-03; просмотров: 1833;
