Спирт — растворитель. 4 страница
Запах уксусной кислоты иногда перебивается запахом альдегида. Чтобы освободиться от альдегида, кислоту нейтрализуют содой и раствор выпаривают. Альдегид при этом улетучивается. К остатку приливают минеральную кислоту и смесь слегка нагревают. Ощущается характерный запах уксусной кислоты.
Получение уксусной кислоты из ее солей. Данный эксперимент является повторением хорошо известного учащимся опыта из курса неорганической химии.
В колбочку с отводной трубкой насыпают 5 г обезвоженного ацетата натрия и добавляют 5 мл концентрированной серной кислоты. Сразу же начинается реакция. Подогревая колбу на горелке, отгоняют уксусную кислоту в пробирку через воздушный холодильник (стеклянную трубку). Если пробирку держать в ледяной воде, можно получить чистую уксусную кислоту в кристаллическом виде.
При необходимости уксусная кислота может быть получена таким способом' в значительных количествах.
Получение кислоты из продуктов сухой перегонки дерева. Ранее было показано (с. 86), что сухая перегонка дерева приводит к выделению дегтярной воды. Поэтому задача получения уксусной кислоты сводится к тому, чтобы удалить из дегтярной воды метанол и ацетон.
Предварительно с помощью лакмуса необходимо убедиться в присутствии кислоты в дегтярной воде.
Имеющееся в распоряжении количество дегтярной воды обрабатывают взмученной в воде известью до появления щелочной реакции на лакмус. При этом уксусная кислота образует ацетат кальция (СН3СОО)2Са. От раствора отгоняют метанол и ацетон или же раствор выпаривают до образования сухого остатка — так называемого древесного порошка, представляющего собой ацетат кальция с избытком извести. Порошок обрабатывают в колбе концентрированной серной кислотой и отгоняют уксусную кислоту, как в предыдущем опыте. В приемнике собирается концентрированная (60—80-процентная) уксусная кислота.
Получение уксусного ангидрида. Учащиеся должны иметь представление о том, что карбоновым кислотам, как и минеральным кислородсодержащим кислотам, соответствуют ангидриды.
При отсутствии в школьной лаборатории уксусного ангидрида (СН3СО)2О для демонстрационных целей он может быть приготовлен по реакции ацетата натрия с хлористым ацетилом:
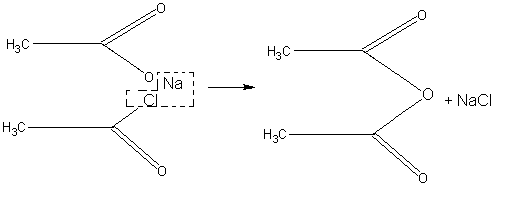
Чтобы жидкий хлористый ацетил по возможности нацело прореагировал и не улетучивался с ангидридом, пользуются избытком нелетучего вещества — ацетата натрия. Опыт проводят в вытяжном шкафу.
В колбу с отводной трубкой помещают 8 г обезвоженного ацетата натрия и приливают маленькими порциями 4—5 мл хлористого ацетила, встряхивая при этом колбу. Реакция образования ангидрида идет с выделением тепла.
К колбе присоединяют воздушный холодильник и отгоняют образующийся ангидрид на пламени горелки (темп. кип. 140°С). Сперва колбу нагревают осторожно, затем нагревание усиливают. Так как ангидрид обычно получается все же с примесью хлористого ацетила, к дистилляту прибавляют 0,5—1 г порошка ацетата натрия, чтобы полностью превратить хлористый ацетил в ангидрид, и снова перегоняют или же сохраняют его с примесью этой соли. Препарат обладает запахом уксусной кислоты. Хранят его в плотно закупоренной склянке. При действии воды на уксусный ангидрид образуется уксусная кислота:
(СН3СО)2O + Н2О à 2СН3СООН
О наличии последней убедительно свидетельствует лакмусовая бумажка.
Получение хлористого ацетила. Хлористый ацетил может оказаться необходимым не только для получения ангидрида уксусной кислоты, но и для синтеза сложных эфиров.
Его получают действием треххлористого фосфора на уксусную
кислоту:
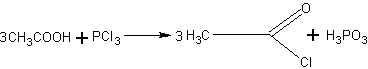
В колбу, соединенную с нисходящим водяным холодильником, помещают ледяную уксусную кислоту и при охлаждении небольшими порциями прибавляют треххлористый фосфор. Затем колбу закрывают пробкой и нагревают в вытяжном шкафу на водяной бане при 45— 50°С. Нагревание ведут до тех пор, пока не прекратится выделение хлороводорода (вследствие взаимодействия трех-
хлористого фосфора с протонсодержащими реагентами) и пока жидкость не разделится на два слоя. Сверху собирается хлористый ацетил, а внизу — фосфористая кислота. Хлористый ацетил отгоняют на водяной бане.
Так как хлористый ацетил чрезвычайно легко разлагается влагой воздуха, то приемник следует закрыть хлоркальциевой трубочкой.
Хлористый ацетил можно отделить от фосфористой кислоты также с помощью делительной воронки.
Непременным условием успеха опыта является использование совершенно сухой посуды. Хранят хлористый ацетил в сухой склянке с плотной пробкой, залитой парафином.
Реакция хлористого ацетила с водой может служить наглядным примером взаимного влияния атомов в молекуле. Чрезвычайная подвижность атома хлора в группировке
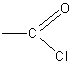
объясняется смещением электронной плотности в сторону кислорода карбонильной группы.
К 5—6 мл холодной воды в пробирке прибавляют несколько капель хлористого ацетила. Хлористый ацетил энергично реагирует с водой, образуя уксусную и соляную кислоты. В этом легко убедиться с помощью лакмуса и раствора нитрата серебра. Если вода для опыта взята недостаточно холодная, реакция происходит мгновенно. Разумеется, никакого подогрева смеси при этом не производится. Уксусный ангидрид реагирует с водой значительно слабее.
Исследование образца уксусной кислоты. Работа представляет интерес для внеклассных занятий по химии, так как знакомит учащихся с приемами контроля химической продукции.
Уксусная кислота может быть различной концентрации и может содержать примесь минеральных кислот, спирта и других органических веществ. Зная способ получения кислоты, учащиеся могут объяснить, как появляются эти примеси.
Концентрацию уксусной кислоты определяют титрованием ее щелочью известной концентрации. Для титрования столового уксуса может быть приготовлен 0,1 М раствор щелочи, для титрования эссенции — молярный раствор. С помощью бюретки берут по
5 мл исследуемого раствора в три конические колбочки, добавляют по 2—3 капли фенолфталеина и титруют из бюретки щелочью до появления остающейся при взбалтывании розовой окраски фенолфталеина. Из трех определений берут среднее арифметическое. Зная, что реакция выражается уравнением
СН3СООН + NaOH à CH3COONa + Н2О
вычисляют молярную, а затем и процентную концентрацию кислоты в исследуемом образце.
Примесь серной кислоты определяют, добавляя к образцу раствор хлорида бария. При отсутствии серной кислоты не должно получаться мути сульфата бария.
Примесь соляной кислоты устанавливают с помощью раствора нитрата серебра. В случае наличия хотя бы незначительного количества соляной кислоты при добавлении раствора нитрата серебра и подкислении азотной кислотой появляется муть или осадок.
Примесь органических соединений устанавливается с помощью слабого (0,1%) раствора перманганата калия. При наличии примесей перманганат обесцвечивается; уксусная кислота в этих условиях, как известно, не окисляется.
Таким способом могут быть исследованы образцы химически чистой уксусной кислоты, столового уксуса, уксусной эссенции и кислоты, полученной учащимися в лаборатории.
МУРАВЬИНАЯ КИСЛОТА
При изучении муравьиной кислоты необходимо поставить опыты, показывающие особенности ее строения и химических свойств.
Разложение муравьиной кислоты на оксид углерода (II) и воду. После того как учащиеся ознакомятся с физическими свойствами муравьиной кислоты (агрегатное состояние, запах, цвет) и вспомнят ее структурную формулу по реакциям окисления формальдегида, целесообразно поставить вопрос о том, как может быть подтверждена ее структурная формула. Учащиеся обращают внимание на то, что молекула муравьиной кислоты построена как бы из молекулы воды и молекулы оксида углерода (II):
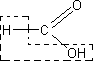
Естественно встает вопрос, нельзя ли получить кислоту реакцией оксида углерода (II) с водой. Учитель сообщает, что эта реак-
ция не идет так просто, как кажется: угарный газ не вступает в реакцию с водой. Но можно провести обратную реакцию: разложить кислоту на оксид углерода (II) и воду. В качестве водоотнимающего средства можно воспользоваться часто применяемой для этой цели серной кислотой. Оксид углерода (II) нетрудно будет обнаружить по его характерному пламени при горении.
В небольшую колбочку (или пробирку) с отводной трубкой наливают 1 мл муравьиной кислоты и 3-4 мл концентрированной серной кислоты. Колбу закрывают пробкой и нагревают в пламени горелки. Образующийся газ собирают в два цилиндра над водой. Во втором цилиндре газ поджигают (в первом — смесь газа с воздухом может дать взрыв). По синей окраске пламени учащиеся узнают оксид углерода (II). После этого поджигают оксид углерода (II) у отводной трубки. Опыт ведут до полного разложения муравьиной кислоты или останавливают его, прекращая нагревание. При проведении опыта необходимо следить, чтобы ядовитый газ не проникал в помещение. Опыт подтверждает формулу муравьиной кислоты.
Окисление муравьиной кислоты. Учащиеся легко устанавливают, что муравьиная кислота одновременно является альдегидом, так как имеет группировку атомов
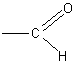
Это дает возможность предположить, что муравьиная кислота должна окисляться легче уксусной, и в частности давать реакцию серебряного зеркала.
До проведения опыта можно высказать предположение и о том, какие вещества будут получаться в результате реакции. Учащиеся составляют уравнение реакции, аналогичное уравнению для альдегидов, и замечают, что образуется угольная кислота:
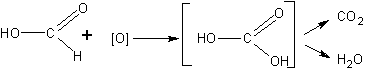
Поскольку угольная кислота, как известно, распадается с образованием углекислого газа, то для большей убедительности опыт, следовательно, надо поставить так, чтобы попытаться обнаружить углекислый газ.
а) Окисление перманганатом калия. В колбочке или пробирке с отводной трубкой к 1 мл муравьиной кислоты приливают 10 мл разбавленного раствора перманганата калия и немного серной кис-
лоты. Нагревают колбу через асбестовую сетку. Отводную трубку опускают в известковую воду. Перманганат калия при реакции обесцвечивается, содержимое колбы пенится от образующегося газа, и известковая вода мутится. Уксусная кислота, как известно, не обесцвечивает перманганат калия.
б). Окисление аммиачным раствором гидроксида серебра. Реакцию проводят как обычно, однако восстанавливающееся серебро при этом чаще всего выделяется не в виде зеркала, а в виде черного
осадка.
Получение муравьиной кислоты. Получение муравьиной кислоты из спирта и альдегида после всего изученного не представляет особого интереса. Значительно важнее было бы показать учащимся получение кислоты синтезом формиата натрия из оксида углерода(II) и едкого натра, что соответствует промышленному способу. Однако необходимость обращения со значительными количествами оксида углерода (II), даже при всей тщательности работы, делает опыт неприемлемым для школы.
При отсутствии в лаборатории муравьиной кислоты она может быть приготовлена нагреванием щавелевой кислоты с глицерином. Щавелевая кислота в этих условиях разлагается, образуя углекислый газ и муравьиную кислоту:
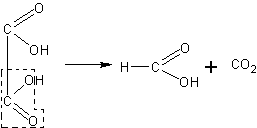
В колбу емкостью 200—250 мл с отводной трубкой помещают 30 г безводного глицерина и 30 г безводной щавелевой кислоты (кислоту обезвоживают осторожным нагреванием в сушильном шкафу при 95 - 100°С). Закрывают колбу пробкой с термометром, шарик которого погружают в смесь веществ. К колбе присоединяют нисходящий холодильник и приемник для дистиллята. Нагревают колбу через асбестированную сетку так, чтобы термометр показывал 110 — 115°С. Около 100°С начинается обильное выделение углекислого газа. При этом начинает отгоняться муравьиная кислота. Когда выделение углекислого газа станет слабым, добавляют вторую порцию (30 г) щавелевой кислоты и снова продолжают перегонку. При необходимости добавляют третью такую же порцию кислоты. После повторной дистилляции удается получить довольно крепкую муравьиную кислоту (темп. кип. кислоты 100°С).
Если почему-либо не удалось приготовить безводную щавелевую кислоту, можно воспользоваться кристаллической кислотой, беря ее всякий раз несколько большее количество. В этом случае будет получаться менее концентрированная кислота, так как одновременно перегоняется значительное количество воды.
Взаимодействие формиата натрия с натронной известью. Учащимся известно, что при нагревании солей карбоновых кислот с натронной известью (или едким натром) образуются соответствующие углеводороды.
Будет очень интересно предложить учащимся решить вопрос о том, какие продукты получатся при нагревании формиата натрия с натронной известью, а затем поставить соответствующий опыт и определить образующиеся вещества.
При реакции получаются водород и карбонат натрия:
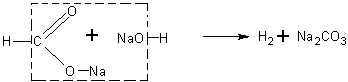
Дата добавления: 2016-01-03; просмотров: 3528;
