Основные производители и поставщики хроматографов
| Страна, фирма | Адрес | Сайт | Логотип |
| США, Agilent, Inc Keysight Technologies | KOSMODAMIANSKAYA NABEREZHANAYA 52/3 MOSCOW Russia 113054 Россия | www.agilent.ru www.keysight.com | 
|
| Германия, Bruker | Bruker Ltd. 119017, Moscow, Russia Pyatnitskaya Str., 50/2-1 Tel: +7 (495) 517-9284; +7 (495) 517-9285 Fax: +7 (495) 517-9286 | www.bruker.com/ | 
|
| Dionex, Inc | www.dionex.com | 
| |
| Япония, Hitachi | Mannheim Office Theodor –Heuss - Anlage 12, 68165 Mannheim, F.R. Germany | www.hitachi-hitec.com/global/science/network/eu.htm | 
|
| Shimadzu | Г. Москва, 119049, 4-ый Добрынинский пер., 8, БЦ «Добрыня», офис С13-01 | www.shimadzu.ru smo@shimadzu.ru | 
|
| Россия, Люмэкс | 192029, Санкт-Петербург, пр. Обуховской Обороны, дом 70, корп. 2 | www.lumex.ru/index.php | 
|
| Россия, ЗАО «Научприбор» Милихром | 192029, Санкт-Петербург, пр. Обуховской Обороны, дом 70, корп. 2 | http://www.nauchpribor.ru/ | |
| Россия, Мультихром | OOO Мультихром ул. Арбузова 1/1 корп. 3 г. Новосибирск 630117 | www.mcc-chrom.ru | 
|
| Россия, ООО «ФизЛабПрибор» | ООО «ФизЛабПрибор» Адрес: 117405, г. Москва, ул. Дорожная, 60Б | www.fizlabpribor.ru/ | 
|
| Россия, ЗАО СКБ "Хроматэк" | 424000, г. Йошкар-Ола, Главпочтамт, а/я 84, ЗАО СКБ «Хроматэк» | www.chromatec.ru | 
|
| Россия, Хромос | Россия, Нижегородская область, г. Дзержинск, улица Лермонтова 20 корпус 83 Почтовый индекс: 606002 | www.has.ru | 
|
| Россия. Цвет | 606000, Нижегородская область, г. Дзержинск, пр. Ленина, д. 48, оф.2215"А" | www.tswet.ru | 
|
| США, Waters | Waters Corporation 34 Maple Street Milford Massachusetts 01757 USA 117246, Москва, Научный проезд, д. 14А «Институт витаминов». | www.waters.com/waters/home.htm | Хроматографы с ДИП часто применяются для мониторинга загрязнений окружающей среды – воды и воздуха. Фирмы – производители хроматографов с различными детекторами приведены в табл. 9.

|
| Германия, Merck | Frankfurter Straße 250 64293 Darmstadt Germany | www.merck.ru | 
|
Методы газовой хроматографии нашли применение не только для качественного и количественного анализа сложных углеводородных смесей, но и для измерения удельной поверхности твердых сыпучих веществ, таких как сорбенты, катализаторы, пигменты и др. Удельная поверхность – это полная поверхность частицы с учётом пор и трещин, на единицу массы пробы. Удельная поверхность – это усреднённая характеристика размеров внутренних полостей (каналов, пор) пористого тела или частиц раздробленной фазы дисперсной системы. Данный параметр является также информативным (получение глинозема как сырья для алюминия, извлечение золота из растворов и пульп, производство цементов, катализаторов и др.), так как позволяет контролировать скорость гетерогенных процессов и управлять качеством готового продукта. Для цементов, катализаторов и сорбентов – это важный показатель качества. Чем больше, чем развитее удельная поверхность частиц, тем выше каталитическая активность или сорбционные характеристики. Для измерения удельной поверхности существует много различных методов, отличающихся друг от друга точностью, производительностью, стоимостью анализа. Первая и вторая группа методов (микроскопический и седиментационный) являются чисто лабораторными методами и неприемлемы для экспресс-анализа и автоматизации. Методы газопроницаемости просты и экспрессны, но дают информацию только о внешней поверхности частиц, без учета внутренних каналов и пор.
Статические методы основаны на определении количества поглощенного газа в зависимости от его давления, т. е. получать изотерму адсорбции. Являясь наиболее точными, статические методы довольно громоздки, весьма длительны (до 5 часов!). Время анализа зависит от дисперсности проб и в соответствии с этим может меняться от 25 до 300 мин. Диапазон измерения поверхности от 0,1 м²/г до 2000 м²/г. Относительная погрешность составляет ±2 %. Статические методы не могут применяться для технологического контроля удельной поверхности ввиду большого запаздывания информации, а используются как эталонные.
Наиболее пригодна для технологических измерений группа адсорбционных динамических методов измерения удельной поверхности. Динамический метод заключается в том, что поток газа или пара пропускают непрерывно через слой адсорбента, в равновесных условиях фиксируют изменение концентрации газа или пара после прохождения адсорбента. Примером динамического метода измерения удельной поверхности является метод тепловой десорбции (метод БЭТ). Этот метод предложен Нельсоном и Эггертсоном, Грубнером [10], усовершенствован Буяновой и Карнауховым [11]. Метод получил широкое распространение и является достаточно чувствительным и менее длительным. Сущность метода тепловой десорбции (МТД) заключается в том, что из смеси адсорбата с газом-носителем производится поглощение адсорбата при охлаждении адсорбента до температуры конденсации. Это временно приводит к уменьшению концентрации адсорбата в смеси, проходящей через измерительную ячейку катарометра, что регистрируется потенциометром и записывается на диаграмме в виде адсорбционного пика. После установления адсорбционного равновесия и восстановления прежнего состава выходной сигнал детектора возвращается к нулевому значению. При повышении температуры адсорбента до комнатной наступает десорбции адсорбата с поверхности адсорбента, концентрация адсорбата в смеси в результате возрастает. Это изменение записывается на мониторе в виде десорбционного пика, направленного в противоположную сторону от нулевой линии по отношению к адсорбционному пику. В качестве адсорбата применяется азот или аргон в смеси с гелием.
Газы и пары адсорбируются поверхностью находящихся в соприкосновении с ними твердых тел. Твердое тело, поглощающее газ или пар, называется адсорбентом, поглощаемое вещество – адсорбатом.
Сорбенты поглощают тем больше вещества из объемной фазы, чем больше развита их поверхность. Поэтому адсорбирующую способность адсорбента можно характеризовать в какой-то степени его удельной поверхностью, т. е. величиной всей поверхности, приходящейся на 1 грамм адсорбента.
Атом или молекула газа при адсорбции насыщает некоторую часть неуравновешенных сил на поверхности твердого вещества – адсорбента и, следовательно, понижает его поверхностное натяжение. Так как при этом уменьшается свободная энергия системы, то все адсорбционные процессы происходят самопроизвольно.
До адсорбции молекулы газа могут двигаться свободно в трех измерениях, а после адсорбции – лишь в двух. Поэтому адсорбция сопровождается уменьшением энтропии системы, а, следовательно, и уменьшением энтальпии. Адсорбционные процессы являются экзотермическими, что подтверждается экспериментально. Уменьшение энтальпии в этих процессах называют теплотой адсорбции. Для физической адсорбции теплота адсорбции имеет порядок теплоты конденсации паров. Если поверхность твердого тела адсорбирует только один слой атомов или молекул газа, то адсорбцию называют мономолекулярной. При адсорбции большего числа слоев на поверхности – полимолекулярной.
В процессе адсорбции газа твердым телом устанавливается равновесие. Такое равновесие подобно равновесному состоянию газа в поле тяжести. Разница только в том, что в случае адсорбции роль гравитационного поля играет поле адсорбционных сил, весьма быстро убывающих с расстоянием от поверхности адсорбента.
 Адсорбционное равновесие можно рассматривать как равновесие простейшего распределения: молекула в газе молекула в адсорбционном слое.
Адсорбционное равновесие можно рассматривать как равновесие простейшего распределения: молекула в газе молекула в адсорбционном слое.
Из закона распределения следует, что
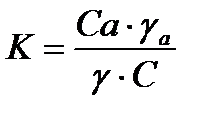
, (29)
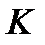
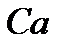 где: – константа равновесия независящая от концентрации и постоянная при неизменной температуре;
где: – константа равновесия независящая от концентрации и постоянная при неизменной температуре;
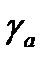 – концентрация газа в адсорбционном слое;
– концентрация газа в адсорбционном слое;
– коэффициент активности в адсорбционном слое;
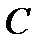
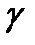 – концентрация газовой фазы;
– концентрация газовой фазы;
– коэффициент активности молекул в газовой фазе.
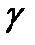
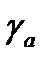 При невысоких концентрация в газовой фазе и при малых значениях коэффициенты активности и равны единице.
При невысоких концентрация в газовой фазе и при малых значениях коэффициенты активности и равны единице.
Поэтому:
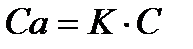 (30)
(30)
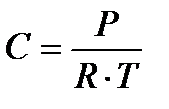 Так как для идеальных газов концентрация газа определяется уравнением
Так как для идеальных газов концентрация газа определяется уравнением
,то (31)
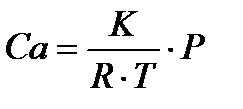 (32)
(32)
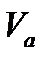 Полное количество газа, приходящегося на единицу массы адсорбента (например, на 1 г), т. е. находящееся в объеме адсорбированного слоя :
Полное количество газа, приходящегося на единицу массы адсорбента (например, на 1 г), т. е. находящееся в объеме адсорбированного слоя :
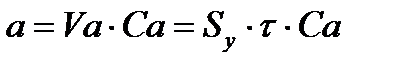
, (33)
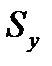
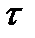 где: – удельная поверхность адсорбента; – толщина адсорбционного слоя.
где: – удельная поверхность адсорбента; – толщина адсорбционного слоя.
Из уравнений (31), (32) и (33) получается:
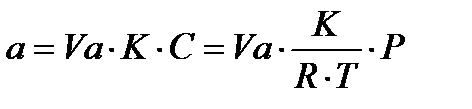 (34)
(34)
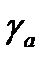
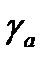 Из уравнения (34), следует, что при малых давлениях газа Р величина адсорбции а (на 1 грамм адсорбента) пропорциональна давлению газа в объеме. Так как все сказанное справедливо при постоянной температуре, то уравнение (34) является простейшим уравнением изотермы адсорбции и называется уравнением Генри для изотермы адсорбции. Константа этого уравнения называется постоянной Генри. При достаточно больших концентрациях или давлении газа наступают отклонения от закона Генри из-за неравенства коэффициента активности единице ( ≠ 1). Неравенство в случае однородной поверхности адсорбента обусловлено силами взаимодействия между молекулами адсорбата в адсорбционном слое. Наиболее часто это силы притяжения: при приближению к предельному заполнению адсорбционного слоя они переходят в силы отталкивания.
Из уравнения (34), следует, что при малых давлениях газа Р величина адсорбции а (на 1 грамм адсорбента) пропорциональна давлению газа в объеме. Так как все сказанное справедливо при постоянной температуре, то уравнение (34) является простейшим уравнением изотермы адсорбции и называется уравнением Генри для изотермы адсорбции. Константа этого уравнения называется постоянной Генри. При достаточно больших концентрациях или давлении газа наступают отклонения от закона Генри из-за неравенства коэффициента активности единице ( ≠ 1). Неравенство в случае однородной поверхности адсорбента обусловлено силами взаимодействия между молекулами адсорбата в адсорбционном слое. Наиболее часто это силы притяжения: при приближению к предельному заполнению адсорбционного слоя они переходят в силы отталкивания.
Уравнением локализованной адсорбции на однородной поверхности при адсорбции в виде мономолекулярного слоя (см.рис.28 и 29) является уравнение Лэнгмюра: 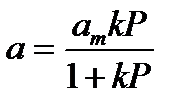 , (35)
, (35)
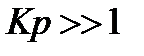 где am – величина адсорбции, соответствующая полному заполнению поверхности (ёмкость монослоя), k – константа, зависящая от энергии взаимодействия и температуры.
где am – величина адсорбции, соответствующая полному заполнению поверхности (ёмкость монослоя), k – константа, зависящая от энергии взаимодействия и температуры.
В области малых концентраций, когда , уравнение (35) переходит в уравнение Генри.
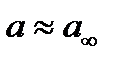
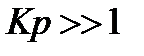 При значительных концентрациях, когда , уравнение (35) превращается в уравнение . При этом наступает насыщение адсорбента, дальнейшая адсорбция прекращается. Таким образом, из уравнения Лэнгмюра следует, что вначале адсорбция возрастает пропорционально увеличению концентрации, затем возрастание замедляется, наконец, когда наступает предел насыщения, прекращается. Следовательно, изотерма адсорбции Лэнгмюра графически представляет собой гиперболу, обращенную выпуклой стороной от оси концентраций и асимптотически приближающуюся к пределу, соответствующему (рис. 33).
При значительных концентрациях, когда , уравнение (35) превращается в уравнение . При этом наступает насыщение адсорбента, дальнейшая адсорбция прекращается. Таким образом, из уравнения Лэнгмюра следует, что вначале адсорбция возрастает пропорционально увеличению концентрации, затем возрастание замедляется, наконец, когда наступает предел насыщения, прекращается. Следовательно, изотерма адсорбции Лэнгмюра графически представляет собой гиперболу, обращенную выпуклой стороной от оси концентраций и асимптотически приближающуюся к пределу, соответствующему (рис. 33).
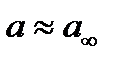
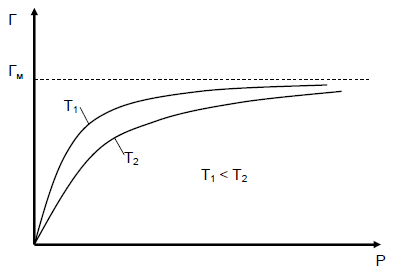
Рис. 33. Изотерма мономолекулярной адсорбции Лэнгмюра
Рис. 34. Физическая модель мономолекулярной адсорбции
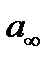
Величина представляет собой количество адсорбированного вещества (в моляхна грамм адсорбента), покрывающие поверхность адсорбента плотным монослоем. Эту величину называют емкостью монослоя. Зная емкость монослоя, можно определить поверхность адсорбента, если известна площадь, занимаемой одной адсорбированной молекулой:
Повышение давления газа при адсорбции может существенно изменить состояние системы и вызвать появление новых закономерностей. Так, при значительном давлении газ переходит в состояние пара, а последний при достижении давления равного давлению насыщения, конденсируется.
При повышении давления сорбтива адсорбция не ограничивается одним слоем адсорбированных молекул, а продолжает расти, переходя, в конце концов, в объемную конденсацию, при давлении равном давлению насыщенного пара (Р=Рs ) при температуре эксперимента.
Теория полимолекулярной адсорбции, разработанная американскими учеными Брунауэром, Эмметом и Теллером (теория БЭТ) в 1938 году, является развитием теории адсорбции Ленгмюра. При Р=Рs адсорбция паров жидкости, смачивающей поверхность адсорбента, становится бесконечно большой. Следовательно, если в области давлений, далекой от насыщения, рост адсорбции замедляется с повышением давления, то с дальнейшим повышением давления – с приближением к Рs , адсорбция начинает возрастать и, наконец, достигает значительной величины Ps. Адсорбционный слой при этом утолщается, адсорбция становится полимолекулярной, а изотерма адсорбции проходит черев точку перегиба и принимает форму, изображенную на рис.35. При достижении Р=Рs наступает объемная конденсация.
Рис. 35. Изотерма полимолекулярной адсорбции
При выведении уравнения изотермы полимолекулярной адсорбции принимается, что при адсорбции пара адсорбированные на уже занятых местах молекулы не покидают их немедленно, но образуют кратные адсорбционные комплексы (рис. 36).
Рис. 36 . Модель полимолекулярной адсорбции по теории БЭТ
По мере приближения к давлению насыщення Рs число свободных мест сокращается, число мест, занятых единичными комплексами, сначала растет, а затем за счет образования двойных комплексов падает и т. д. Принимаются также допущения, которые были сделаны при выводе уравнения Лэнгмюра, и рассматривается полимолекулярная адсорбция пара на однородной поверхности как серия квазихимических реакций образования единичных и кратных комплексов:
пар + поверхность единичные комплексы
пар + единичные комплексы двойные комплексы
пар + двойные комплексы тройные комплексы и т. д.
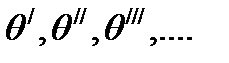 Если – доли поверхности, покрытые единичными, двойными, тройными и т. д. комплексами, то общая величина адсорбции с учетом кратности каждого комплекса будет равна:
Если – доли поверхности, покрытые единичными, двойными, тройными и т. д. комплексами, то общая величина адсорбции с учетом кратности каждого комплекса будет равна:
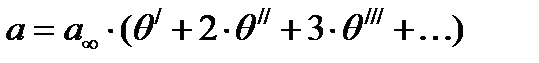
(36)
Полученное Брунауэром, Эмметом и Теллером двухконстантное уравнение полимолекулярной адсорбции (уравнение БЭТ) имеет вид:
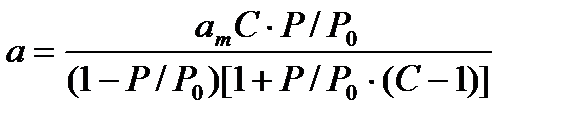 , (37)
, (37)
где а – величина адсорбции, см3/г, am – емкость монослоя в модели БЭТ, моль/г, С – энергетическая константа, связанная с теплотой адсорбции, зависит от природы сорбента, Р – равновесноедавление паров адсорбата при температуре адсорбции (77 К), Р0 – упругость насыщенных паров адсорбата, Р/Р0 – относительное давлениепаров адсорбата.
Исходя из уравнения БЭТ можно определить удельную поверхность адсорбента. Для этого уравнение БЭТ преобразовывают так, чтобы зависимость адсорбции от равновесного давления паров выражалась линейным уравнением. Тогда уравнение БЭТ примет вид:
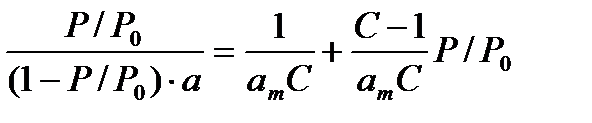 (38)
(38)
График этого уравнения в координатах Р/Р0 и а – прямая линия.
Эта прямая отсекает на оси ординат отрезок D = 1/amC, а тангенс угла ее наклона равен E = (C-1)/amC.Из величин D и E путем несложных расчетов можно вычислить константы уравнения: am и С.
Авторы теории БЭТ предложили вычислять удельную поверхность S как произведение ёмкости монослоя и площадь, приходящаяся на одну молекулу адсорбата на число Авогадро по уравнению [1]:
S = am ∙N ∙ωm , (39)
где S – площадь поверхности адсорбата; N - число Авогадро, равное 6,02∙1023 шт/моль, ωm – площадь, приходящаяся на одну молекулу в монослое, равная, как показали дополнительные эксперименты, для молекулы азота 0,162 нм2, а для молекулы аргона 0,176 нм2.
Пример использования уравнения БЭТ для расчета величины удельной поверхности пористого материала и экспериментальные данные по адсорбции паров азота при 77 К на образце диоксида титана (рис.37) приведены в [2].
Рис. 37. Изотерма адсорбции азота (77К) на образце диоксида титана.
Расчет величины удельной поверхности по уравнению (39) с учетом размерностей всех входящих множителей имеет вид:
S = 57,5 ∙10-3[дм3/г]∙ 6,02 1023[шт/моль]∙ 0,162 ∙10-18 [м2/шт] ∙ 22,4-1[дм3/моль]
= 250 м2/г.
Таблица 10
Серийно выпускаемые анализаторы удельной поверхности, работающие по методу тепловой десорбции (БЭТ)
| Наименование | Производитель | Погрешность, ±% | Время анализа, мин | Газ-носитель/ адсорбат | Sу, м2/г |
| Сорбтометр | Россия/ ЗАО «МЕТА», г. Новосибирск | 5–10 | 8–60 | Гелий, аргон, азот | от 0,3 до 2000 |
| SorbiPrep | Россия/ ЗАО «МЕТА», г. Новосибирск | – | 1–99 | Любой инертный газ | – |
| Sorbi-MS | Россия/ ЗАО «МЕТА», г. Новосибирск | азот | 0,01... | ||
| Sorbi-M | Россия/ ЗАО «МЕТА», г. Новосибирск | 20–40 | Азот, аргон | 0,01...2000 | |
| Quadrasorb SL | Pittsburgh/ Giangarlo Scientific Co., Inc. | азот или любой некорродирующий газ | от < 0,05 | ||
| Ultrafoam 1200e | Florida/ Quantachrome Instruments | Азот | 0,01...1350 | ||
| Nova 1000* | Florida/ Quantachrome Instruments | Азот | 0,01... | ||
| Monosorb | Kultronix/ Франция | Азот, аргон, криптон, СО2 | 0,1...250 |
Прибор СОРБИ-М (табл.10, рис. 38) предназначен для измерения удельной поверхности дисперсных и пористых материалов путем сравнения объемов газа-адсорбата, сорбируемого исследуемым образцом и стандартным образцом материала с известной удельной поверхностью. В качестве газа-адсорбата в данной модификации используется азот. Измерение удельной поверхности проводится по 4-х точечному методу БЭТ. Для измерения количества адсорбированного газа используется метод тепловой десорбции. В этом случае через исследуемый образец при температуре кипения жидкого азота пропускают стационарный поток смеси газа-носителя (гелия) и газа-адсорбата (азота) заданного состава. Газовую смесь пропускают до установления равновесия между концентрациями адсорбата в газовой и адсорбционной фазах. Затем образец нагревают от температуры кипения жидкого азота до температуры полной десорбции газа-адсорбата с поверхности образца.

| |
| |
Рис. 38. Общий вид анализатора
1 ̶ линзовая наклейка; 2 ̶ узел забора газа; 3 ̶ панель индикации; 4 ̶ соединитель газовый (выход газовой смеси); 5 ̶ маркировочная табличка; 6 ̶ штуцер и трубка для выливки жидкого азота.
Изменение концентрации газа-адсорбата в потоке газовой смеси в ходе процессов «адсорбции-десорбции» регистрируется с помощью детектора состава газа (детектора по теплопроводности). Выходным рабочим сигналом детектора является десорбционный пик газа-адсорбата. Площадь этого пика прямо пропорциональна объёму десорбированного газа.
По результатам измерений объёмов газа, сорбируемого на испытуемом образце при четырёх значениях парциального давления, с помощью уравнения БЭТ рассчитывается значение удельной поверхности.
Для градуировки прибора используется стандартный образец с аттестованной удельной поверхностью.
Как следует из таблицы 10, по сравнению со статическими методами метод тепловой десорбции (БЭТ) имеет ряд существенных преимуществ, но в то же время не лишен недостатков, главными из которых являются длительность анализа и обязательное наличие криостатов. Кроме того, это и необходимость тренировки образца, которая предусматривает выдержку образца в потоке газа-носителя при значительных температурах (до+200 °С). Многие образцы при таких температурах разлагаются. Альтернативой для экспресс-анализа в промышленных условиях могут служить анализаторы, работающие на основе высокотемпературного метода тепловой десорбции (ВМТД). Суть метода ВМТД заключается в определении объема адсорбата, адсорбированного на поверхности анализируемой пробы из потока парогазовой смеси при плюсовой температуре, затем десорбированного из неё при повышении температуры до 100 ºС, последующем интегрировании сигнала и расчёте удельной поверхности по программе, составленной для контроллера [ 12].
Сорбтометр имеет блочную конструкцию (рис. 37) и состоит из: блока подготовки воздуха (БПВ); блока адсорбера (БА); блока детектора (БД); блока измерительно-преобразующего (БИП); программно-логического контроллера (ПЛК); термостата детектора; термостата адсорбера; панели оператора (ИП); ноутбука с ПО.
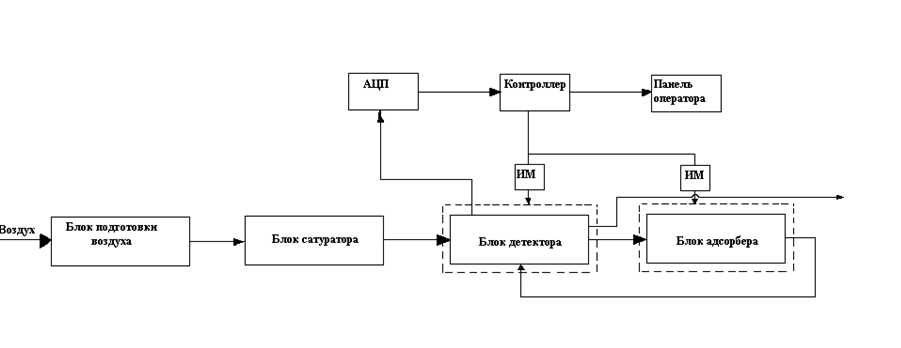
Рис 39. Структурная схема анализатора удельной поверхности (ВМТД)
Контроль процесса определения удельной поверхности производится путем подключения прибора к ПК. Пользовательский интерфейс выполнен в SCADA- Trace Mode 6. В данную систему визуализации вынесены величины температуры детектора и адсорбера, контроль объёма воздуха на выходе, время анализа, тренд адсорбции, что позволяет управлять процессом в автоматическом режиме и представлять процессы измерений в графическом виде в реальном масштабе времени.
Созданный интерфейс позволяет управлять процессом (подача воздуха, нагрев) непосредственно с монитора компьютера. Программный код написан на языке FBD.
Дата добавления: 2016-01-03; просмотров: 4567;
