Лекция 7. Хроматографы
Принцип действия, история открытия метода. Уравнение Ленгмюра и Генри. Параметры хроматограммы. Устройство газового хроматографа. Типы детекторов. Применение газовой хроматографии
для измерения удельной поверхности. Сорбтометр.
Хроматогра́фия (от др.-греч. χρῶμα – цвет) – это метод разделения и анализа смесей жидкостей и паров, а также изучения физико-химических свойств веществ. Основан на различном распределении веществ между двумя фазами – неподвижной (твердая фаза или жидкость, связанная на инертном носителе) и подвижной (газовая – газ-носитель или жидкая фаза, элюент). Хроматография – метод разделения смесей веществ или частиц основанный на различиях в скоростях их перемещения в системе несмешивающихся и движущихся относительно друг друга фаз.
Честь открытия (1903 г.) хроматографии принадлежит российскому ученому – ботанику Михаилу Семеновичу Цвету [3]. Свое открытие М.С. Цвет сделал в стеклянной пробирке, изучая растительные пигменты. Название метода связано с первыми экспериментами по хроматографии, в ходе которых Михаил Цвет разделял ярко окрашенные растительные пигменты. Он использовал пробирку, заполненную карбонатом кальция, для разделения пигментов растительного происхождения. Первая печатная работа по хроматографии была опубликована в 1903 году, в журнале «Труды Варшавского общества естествоиспытателей». В 1910 –1930 годы метод был незаслуженно забыт и практически не развивался. Начиная с 1931 года и до наших дней хроматография бурно развивалась и стала одним из наиболее широко применяемых методов анализа концентрации и состава многокомпонентных смесей. Появились такие разновидности метода, как распределительная, ионообменная, газовая, жидкостная хроматография. В 1952 году Дж. Мартину и Р. Сингу была присуждена Нобелевская премия в области химии за создание метода распределительной хроматографии.
Хроматографические методы анализа имеют много разновидностей в зависимости от природы и агрегатному состоянию неподвижной и подвижной фаз, механизма сорбции, способа подачи пробы и др.
По физической природе неподвижной и подвижной фаз хроматография делится на жидкостную и газовую.
Жидкостная хроматография ЖХ (если подвижная фаза жидкая) и газовая хроматография ГХ (если подвижная фаза газообразная). Жидкостную хроматографию в свою очередь можно разделить в зависимости от агрегатного состояния неподвижной фазы на твердо-жидкофазную (ТЖХ) – неподвижная фаза твердая и жидко-жидкофазную хроматографию (ЖЖХ) – неподвижная фаза жидкая. ЖЖХ часто называют распределительной хроматографией.
Газовую хроматографию в зависимости от агрегатного состояния неподвижной фазы делят на газоадсорбционную (ГТХ, ГАХ) и газожидкостную (ГЖХ) или газораспределительную.
В зависимости от способа перемещения сорбатов вдоль слоя сорбента различают проявительный (элюентный), фронтальный, вытеснительный методы и электрохроматографию.
При использовании проявительного метода пробу исследуемой смеси вводят порцией в начальной точке (вход в колонку) на слой хроматографической насадки (сорбента). Под действием потока подвижной фазы зона пробы начинает перемещаться вдоль колонки, причем скорости перемещения отдельных компонентов пробы обратно пропорциональны величинам соответствующих им констант распределения.
В методе фронтальной хроматографии разделяемая смесь непрерывно поступает на слой сорбента в начальной точке и, таким образом, фактически играет роль подвижной фазы. Методика проведения разделения вытеснителъным методом аналогична методике проведения разделения проявительным методом, но без использования несорбирующегося элюента (подвижной фазы). Перемещение хроматографических зон достигается путем вытеснения компонентов разделяемой смеси веществом, которое сорбирует сильнее любого из этих компонентов. Каждый компонент этой пробы вытесняет компоненты, которые взаимодействуют с неподвижной фазой менее сильно, чем он сам. Для аналитических целей наиболее широко используется элюентный (проявительный) метод хроматографирования. Электрохроматография — хроматографический процесс, при котором движение заряженных частиц осуществляется под действием приложенного напряжения. Скорость движения частиц определяется их массой и зарядом.
В зависимости от природы процесса, обусловливающего распределение сорбатов между подвижной и неподвижной фазами, различают адсорбционную, распределительную, ионообменную, осадочную, аффинную и эксклюзионную хроматографию.
В адсорбционной хроматографии разделение за счет адсорбции основано на различии адсобируемости компонентов смеси на данном адсорбенте. В распределительной хроматографии разделение основано на различии в растворимости сорбатов в подвижной и неподвижной фазах или на различии в стабильности образующихся комплексов. В ионообменной хроматографии разделение основано на различии констант ионообменного равновесия. В осадочной хроматографии разделение основано на различной растворимости осадков в подвижной фазе. Аффинная хроматография основана на биоспецифическом взаимодействии компонентов с аффинным лигандом. В эксклюзионной хроматографии разделение основано на различии и проницаемости молекул разделяемых веществ в неподвижную фазу. Компоненты элюируются в порядке уменьшения их молекулярной массы.
В зависимости от механизма сорбции хроматография подразделяется на молекулярную, ситовую, хемосорбционную и ионообменную. В молекулярной хроматографии природой сил взаимодействия между неподвижной фазой (сорбентом) и компонентами разделяемой смеси являются межмолекулярные силы типа сил Ван-дер-Ваальса. К хемосорбционной хроматографии относят осадочную, комплексообразовательную (или лигандообменную), окислительно-восстановительную. Причиной сорбции в хемосорбционной хроматографии являются соответствующие химические реакции.
По технике выполнения (характеру процесса) различают: колоночную хроматографию (неподвижная фаза находится в колонке); плоскостную (планарную) — бумажную и тонкослойную (неподвижная фаза – лист бумаги или тонкий слой сорбента на стеклянной или металлической пластинке); капиллярную хроматографию (разделение происходит в пленке жидкости или слое сорбента, размещенном на внутренней стенке трубки); хроматографию в полях (электрических, магнитных, центробежных и других сил).
В зависимости от цели проведения хроматографического процесса различают аналитическую, неаналитическую, препаративную и промышленную хроматографию. Аналитическая хроматография предназначена для определения качественного и количественного состава исследуемой смеси.
По рабочему давлениюхроматография низкого давления (FPLC), хроматография высокого давления (HPLC), хроматография ультравысокого давления (UHPLC).
Наиболее часто используемый вариант проведения аналитической хроматографии – метод ГХ. Анализируемую смесь вводят в поток элюента в виде импульса. В колонке смесь разделяется на отдельные компоненты, между которыми находятся зоны подвижной фазы. Метод ГХ – один из самых современных методов многокомпонентного анализа, его отличительные черты – экспрессность, высокая точность, чувствительность, автоматизация. Метод позволяет решить многие аналитические проблемы. Количественный ГХ анализ можно рассматривать как самостоятельный аналитический метод, более эффективный при разделении веществ, относящихся к одному и тому же классу (углеводороды, органические кислоты, спирты и т. д.). Этот метод незаменим в нефтехимии (бензины содержат сотни соединений, а керосины и масла – тысячи), его используют при определении пестицидов, удобрений, лекарственных препаратов, витаминов, наркотиков и др. При анализе сложных многокомпонентных смесей успешно применяют метод капиллярной хроматографии. Возможности метода ГХ существенно расширяются при использовании реакционной газовой хроматографии (РГХ) вследствие того, что многие нелетучие, термонеустойчивые или агрессивные вещества непосредственно перед введением в хроматографическую колонку могут быть переведены с помощью химических реакций в другие – более летучие и устойчивые. Химические превращения осуществляют чаще на входе в хроматографическую колонку, иногда в самой колонке или на выходе из нее перед детектором. Значительно удобнее проводить превращения вне хроматографа. Недостатки метода РГХ связаны с появлением новых источников ошибок и возрастанием времени анализа. Реакционную хроматографию часто используют при определении содержания микроколичеств воды. Вода реагирует с гидридами металлов, с карбидом кальция или металлическим натрием и др., продукты реакции (водород, ацетилен) детектируются с высокой чувствительностью пламенно-ионизационным детектором. К парам воды этот детектор малочувствителен. Широко применяют химические превращения в анализе термически неустойчивых биологических смесей. Обычно анализируют производные аминокислот, жирных кислот С10 – C20, сахаров, стероидов. Для изучения высокомолекулярных соединений (олигомеры, полимеры, каучуки. смолы и т. д.) по продуктам их разложения используют пиролизную хроматографию. В этом методе испарение пробы заменяют пиролизом. Карбонаты металлов можно проанализировать по выделяющемуся диоксиду углерода при обработке их кислотами. Методом газовой хроматографии можно определять металлы, переводя их в летучие хелаты. При помощи газового хроматографа, установленного на космической станции "Венера-12", был определен состав атмосферы Венеры. Газовые хроматографы устанавливают в жилых отсеках космических кораблей: организм человека выделяет много вредных веществ, и их накопление может привести к большим неприятностям. При превышении допустимых норм вредных веществ автоматическая система хроматографа дает команду прибору, который очищает воздух.
Принцип действия газового хроматографа основан на различной сорбируемости компонентов смесей газов или жидкостей на твердой поверхности, называемой процессом адсорбции.
Адсорбция – процесс поглощения газов или паров из газовых, парогазовых или жидких смесей твердыми поглотителями – адсорбентами. Адсорбция применяется главным образом при небольших концентрациях поглощаемых вещества в исходных смесях, когда требуется достичь практически полного извлечения одного из веществ. Зависимость между величиной адсорбции и концентрацией вещества при постоянной температуре описывается уравнением Ленгмюра. В соответствии с теорией Ленгмюра количество а вещества, поглощаемого единицей массы адсорбента в равновесном состоянии, равно:
а = тbС/(1+bС), (18)
где т и b – постоянные, зависящие от свойств адсорбента и адсорбируемого вещества (сорбата); С– концентрация раствора.
Если С<< 1, то а = тbС (уравнение прямой, выходящей из начала координат). Этот случай соответствует уравнению Генри: а = ГС, где Г– коэффициент Генри.
Если С>> 1, то а = mbC/ bC = m – уравнение прямой, параллельной оси абсцисс.
При адсорбции смеси из п - компонентов уравнение (18) для i-ro компонента имеет вид
. ai= mi biCi/(l + 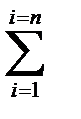 biСi (19)
biСi (19)
Графическая зависимость а = f (С) при постоянной температуре, называемая изотермой адсорбции и является основной характеристикой адсорбционной способности сорбента (рис. 24).
Рис.24. Изотерма процесса адсорбции
а – величина адсорбции; С – концентрация анализируемого вещества; аω – емкость монослоя.
Зависимость количества адсорбированного вещества от температуры при постоянном давлении выражается уравнением изобары адсорбции:
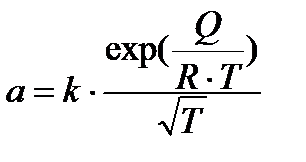 , (20)
, (20)
где к – константа; Q– теплота адсорбции; R– универсальная газовая постоянная; Т– абсолютная температура.
Газовый аналитический хроматограф представляет собой совокупность взаимодействующих систем, предназначенных для проведения анализа в оптимальном режиме после хроматографического разделения исследуемой смеси с целью определения ее состава путем преобразования изменения ее физических и физико-химических свойств в электрический сигнал. Принцип действия хроматографа основан на применении методов газо-адсорбционной и газожидкостной хроматографии в изотермическом режиме. Проба вводится в испаритель Ис (рис. 25, 26), в котором она нагревается (испаряется) и вместе с газом-носителем поступает в хроматографическую колонку К. За счет разной сорбции компонентов смеси на поверхности адсорбента или за счет различной растворимости компонентов в пленке неподвижной фазы, нанесенной на поверхность адсорбента, наполняющего колонку, компоненты перемещаются по колонке с различной скоростью. Вследствие этого компоненты пробы выходят из колонки разделенными один за другим в потоке газа-носителя и регистрируются детектором Д в виде пиков. Определение количественных характеристик разделенных компонентов осуществляется при помощи детектора, который преобразует концентрации компонентов в электрические сигналы. Электрические сигналы усиливаются, преобразуются в цифровой код с помощью аналого-цифрового преобразователя, обрабатываются при помощи бортового микропроцессорного контроллера 10 и передаются в ПК или на панель оператора для обработки в соответствии с программой обработки.
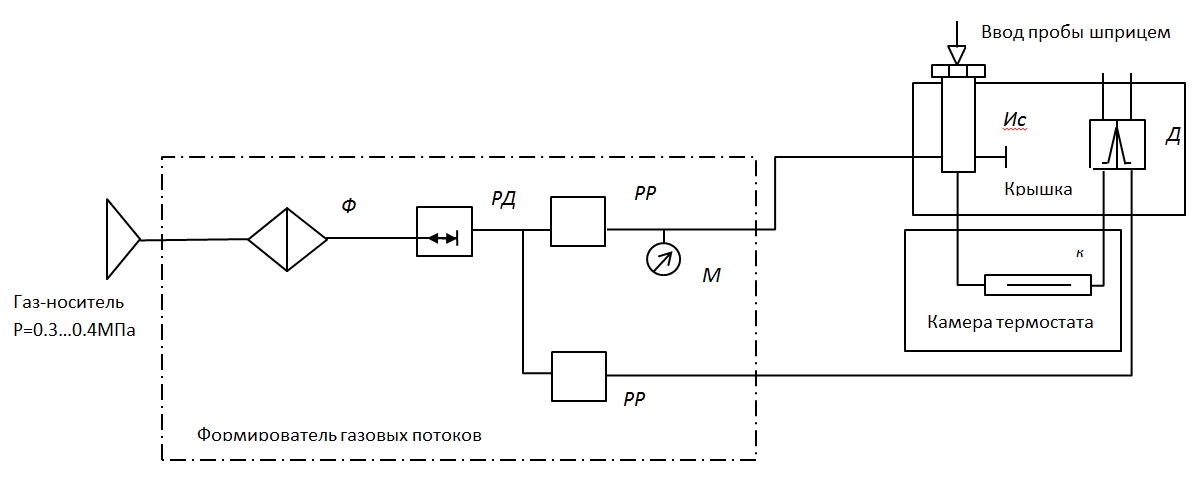
Рис. 25. Принципиальная газовая схема хроматографа:
Ф – фильтр газа-носителя; РД1 – регулятор давления; РР – регулятор расхода; М – манометр; К – хроматографическая колонка; Ис – испаритель; Д – детектор хроматографа.
ПК также выполняет функции задания температурного режима работы хроматографа.
Фазовое равновесие между раствором газа в жидкости и газовой смесью над жидкостью в процессе абсорбции газа при температуре ниже критической системы жидкость – насыщенный пар характеризуется законом Рауля:
РП = РН С, (21)
где РП – парциальное давление компонента в парах над жидкостью; РН – давление насыщенного пара чистого компонента при данной температуре;' См – мольная доля данного компонента в растворе.
Площадь пика, пропорциональную массе q вещества, определяют с использованием интегрирующих измерительных приборов, специальных вычислительных устройств и ПК либо рассчитывают аппроксимацией площади пика через площадь треугольника:
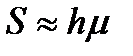 , (22)
, (22)
где 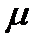 - ширина пика при h/2, h – высота пика (рис.27).
- ширина пика при h/2, h – высота пика (рис.27).
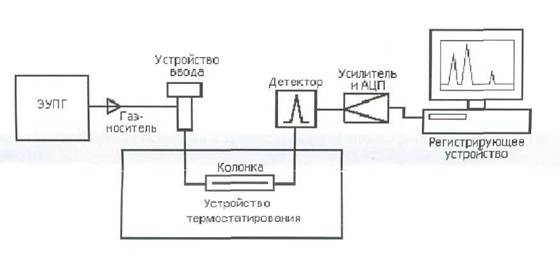
Рис. 26. Блок- схема газового хроматографа
Градуировочная характеристика хроматографа в зависимости от того, какой параметр принят в качестве выходного сигнала (h или S), выражается уравнениями:
h = khq; s = ksq, (23)
где kh – чувствительность хроматографа; ks – величина, пропорциональная чувствительности.
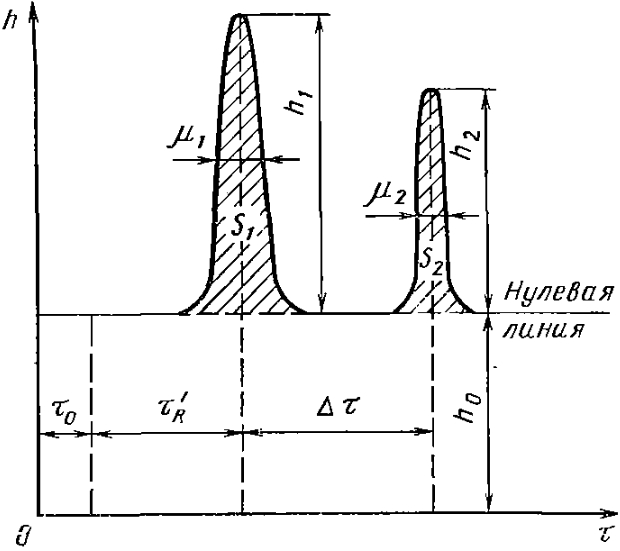

Рис. 27. Хроматограмма двухкомпонентной смеси
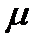 – ширина пика на высоте пика h/2 (полуширина); h – высота пика; τ – время, с; τ0 – время нахождения компонента в подвижной фазе; τR - время
– ширина пика на высоте пика h/2 (полуширина); h – высота пика; τ – время, с; τ0 – время нахождения компонента в подвижной фазе; τR - время
нахождения компонента в сорбенте (неподвижной фазе).
Для оценки предельных аналитических возможностей хроматографов по чувствительности и сравнения хроматографов различных типов используют характеристику, называемую пределом обнаружения Cmin:
Cmin= 2∆q/(hПµ) (24)
где ∆ – уровень флуктуационных шумов нулевого сигнала хроматографа (нулевой сигнал – сигнал хроматографа при отсутствии в подвижной фазе анализируемых компонентов); hП – амплитуда максимума хроматографического пика, приведенная к шкале, на которой измерена величина ∆.
При постоянных условиях хроматографического разделения (температура в колонке, скорость подвижной фазы, геометрические параметры колонки, свойства и количество неподвижной фазы) каждый компонент анализируемой смеси проходит через колонку в течение строго определенного времени, являющегося таким образом качественной характеристикой, позволяющей распознавать компоненты анализируемой смеси. Время от момента ввода дозы в хроматограф до момента получения максимума хроматографического пика называется временем удерживания 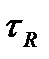 . В колонке оно складывается из двух составляющих: времени
. В колонке оно складывается из двух составляющих: времени 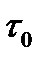 нахождения вещества в подвижной фазе и времени
нахождения вещества в подвижной фазе и времени 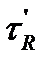 , в течение которого вещество находится в сорбенте:
, в течение которого вещество находится в сорбенте:
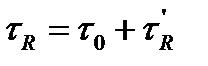 (25)
(25)
Время удерживания зависит от скорости подвижной фазы, поэтому на практике используют понятие удерживаемого объема:
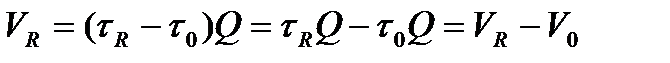 , (26)
, (26)
где V0 – объем пустот в колонке (в хроматографе V0 складывается из свободных объемов всех устройств, через которые проходит анализируемая смесь); Q – объемный расход подвижной фазы.
Совокупность хроматографических пиков, зарегистрированных в процессе разделения дозы исследуемой смеси, образует хроматограмму (см. рис. 28); нулевая линия соответствует нулевому сигналу хроматографа. Количество определяемых компонентов газовым хроматографом определяется длиной хроматографической колонки.
Метрологическими параметрами хроматографов являются:
- время удерживания;
- коэффициент ёмкости;
- коэффициент удерживания;
- коэффициент распределения.
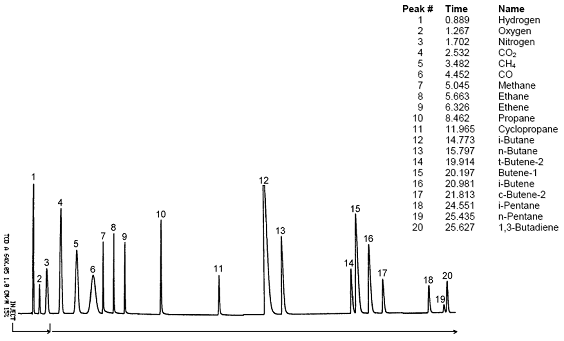
Рис. 28. Пример хроматограммы разделения смеси газов с использованием ГХ.
Дата добавления: 2016-01-03; просмотров: 4191;
