Структурные формулы
Валентность и степень окисления
Валентность
В процессе формирования количественной теории химии, в середине прошлого века было введено и стало общепринятым понятие валентности, которое легло в основу современной теории строения в химии.
Наиболее часто можно встретить следующее определение валентности:
Валентность — это способность атома образовывать определенное количество связей с другими атомами.
Однако это определение страдает рядом недостатков. Во-первых, мы все время говорим о валентности как о числе (валентность кислорода — два), а способность числом не характеризуется. Поэтому возникает другой вариант:
Валентность — это число связей, которое атом данного элемента может образовать с атомами других элементов.
Но и здесь возникает проблема. Ведь, например, для ионных соединений не имеет смысла понятие числа связей (в кристалле хлорида натрия каждый атом натрия связан ионной связью с каждым атомом хлора в кристалле и наоборот). Будьте очень осторожны, используя понятие валентности в случае ионных соединений! Наиболее общим будет, видимо, следующее определение:

В современной химии принята спиновая теория валентности.
Согласно ей, валентность атома определяется количеством имеющихся у него неспаренных электронов. Такие электроны в атоме
называются валентными. Считается, что при образовании связи
эти электроны спариваются с аналогичными электронами других
атомов и выделяющаяся при этом энергия и составляет основу прочности химической связи.
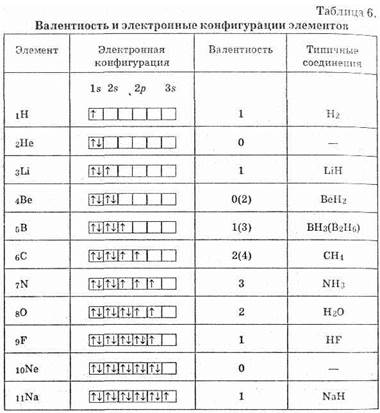
Рассмотрим электронные структуры первых 10 элементов периодической системы и сопоставим их с обычными валентностями этих элементов (табл. 6). Мы видим, что у водорода, лития, азота, кислорода, фтора их типичные валентности действительно совпадают с числом неспаренных электронов. Также это верно для гелия и неона — они не имеют неспаренных электронов я поэтому не образуют соединений. Однако это не так для бериллия, бора и углерода. Почему?
Мы написали в таблице электронные конфигурации атомов в устойчивом состоянии. Однако, если атом получает некоторую энергию, то он может изменить свою электронную конфигура-
цию. Так, в атоме углерода возможен переход одного из спаренных 2s-злектронов на вакантную р-орбиталь (распаривание):
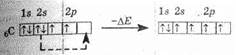
При этом, разумеется, будет затрачена энергия (DE1). Однако далее у атома углерода появляются два дополнительных валентных электрона, он сможет образовать две химические связи, и при этом выделится энергия (обозначим ее DE2). Понятно, что если DЕ2>DE1, то в общем процесс будет выгоден, что и наблюдается. То же самое происходит и в случае бора и бериллия.
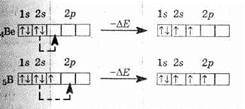
Почему тогда нет соединений четырехвалентного кислорода или соединений неона? Ведь у них есть вакантная 3s-орбиталь, на ; которую может быть переведен 2р-электрон. Дело в том, что в случае бериллия, бора, углерода переход электрона происходит в пределах одного электронного уровня, DЕ1 не велика и энергия образования химической связи (DЕ2),как правило, превышает ее. Но для перехода между разными электронными уровнями DE1 очень велика, и в подавляющем большинстве случаев энергия образования химической связи не может ее компенсировать. Однако принципиально это возможно: так, в 1962 году после долгих усилий были получены соединения ксенона (который является аналогом неона) — XeF2, XeF4 и другие.
Значительно более строгим и однозначным понятием, чем валентность, является понятие степени окисления.
Степень окисления атома (элемента) относится к основным понятиям химии. Оно введено для характеристики состояния атома в соединении.
При определении этого понятия условно предполагают, что
единении связывающие (валентные) электроны переходят
к более электроотрицательным атомам (см. §6.3.4), а потому
соединения состоят только из положительно и отрицательно
'заряженных ионов. В действительности же в большинстве слу-
чаев происходит не полная отдача электронов, а только смещение электронной пары, или, точнее, связующего электронного облака от одного атома к другому.

Это понятие можно определить и иначе:

Из приведенных определений следует, что степень окисления выражает значение электрического заряда (в единицах заряда электрона) и основывается на предположении о принадлежности электронов каждой связи в молекуле или иона более электроотрицательным атомам.
Степень окисления может иметь отрицательное, положительное и нулевое значение, которое обычно выражают арабскими цифрами со знаком «+» или «-» и ставят над символом элемента.
+ 1 -2 о
Например, Na2O, Cl2.
Отрицательное значение степени окисления имеют атомы, которые приняли электроны от других атомов, т.е. в их сторону смещено связующее электронное облако. Отрицательную степень окисления (-1) имеет атом фтора во всех его соединениях.
Положительное значение степени окисления имеют атомы, отдающие свои электроны другим атомам, т.е. связующее электронное облако оттянуто от них. К таковым относятся металлы в соединениях. Степень окисления щелочных металлов равна +1, а щелочноземельных +2.
Нулевое значение степени окисления имеют атомы в молекулах простых веществ, например водорода, хлора, азота, т.к. в этом случае электронное облако в равной мере принадлежит обоим атомам. Если вещество находится в атомном состоянии, то степень окисления его атомов также равна нулю.
Степень окисления может представлять собой и дробное число. Например, степень окисления железа в магнитном железняке Fe3O4 равна +8/3. Дробные степени окисления не имеют
смысла при объяснении связи в химических соединениях, но они могут быть использованы для составления уравнений окислительно-восстановительных реакций.
У одноатомных ионов степень окисления равна заряду иона: для иона К++1, для иона Ва2++2, для иона S2--2 и т.д. В большинстве соединений атомы водорода имеют степень окисления +1, только в гидридах металлов, например NaH, CaH2> она равна -1. Кислород в большинстве соединений имеет степень окисления -2, но, например, в соединении с фтором F2O +2, а в пероксидах -1.
Пользуясь этими сведениями, можно вычислить степень окисления атомов в сложных соединениях, учитывая, что алгебраическая сумма степеней окисления атомов в соединении всегда равна нулю, а в сложном ионе — заряду иона.
В качестве примера вычислим степень окисления фосфора в фосфорной кислоте Н3РО4. Сумма всех степеней окисления атомов в соединении должна быть равна нулю. Поэтому, обозначив степень окисления фосфора через х и умножив известные нам степени окисления водорода (+1) и кислорода (-2) на число их атомов в соединении, составим уравнение
(+1)•3+х+(-2) •4 = 0, отсюда х=+5
Допустим, требуется найти степень окисления хрома в ионе Cr2О72-. Сумма всех степеней окисления атомов в ионе должна быть равна заряду иона. Тогда 2х+(-2)•7=-2, отсюда 2х=+12, а х=+6.
Многие атомы (а значит, и элементы) имеют несколько значений степени окисления. В качестве примера можно привести элементы VII группы периодической системы — хлор и марганец. В соляной кислоте степень окисления хлора равна -1, в свободном состоянии в молекуле Сl2 равна нулю; в кислотах: хлорноватистой НСlO, хлористой НСlO2, хлорноватой НСlO3, хлорной НСlO4 — она соответственно равна +1, +3, +5, +7. В соединениях MnO, Mn2O3, MnO2, Mn3O4, K2MnO4, KMnO4 степень окисления марганца соответственно равна +2, +3, +4, +8/3, +6, +7. У атомов VII группы высшая положительная степень окисления равна +7.
У атомов элементов VI группы, например у серы, в соединениях наиболее характерные степени окисления -2, +4, +6. Высшая положительная степень окисления элемента равна +6.
В V группе азот в соединениях HNO3, NO2, HNO2, NO, N2O, NH3 проявляет степени окисления +5, +4.+3, +2.+1, -3 соответственно. Высшая положительная степень окисления равна +5.
В соединениях элементов IV группы высшая степень окисления равна +4, у элементов III группы +3, у элементов II группы +2, а у щелочных металлов +1.
Зная степени окисления, составляют формулы бинарных соединений. Так, чтобы определить формулу нитрида кремния, по таблице определяем, что у азота большая относительная электроотрицательность, чем у кремния. Число электронов, смещаемых к азоту, равно 4, и степень окисления кремния +4. К атому азота может сместиться 3 электрона (на его р-орбиталях 3 неспаренных электрона). Тогда степень окисления азота будет равна -3, а формула соединения Si+4 и N-3 будет Si3N4.
Высшая положительная степень окисления проявляется, когда в образовании связи принимают участие все валентные электроны атома. Численно она равна номеру группы периодической системы и является важной количественной характеристикой элемента в его соединениях. Наименьшее значение степени окисления элемента, которое встречается в его соединениях, принято называть низшей степенью окисления. Все остальные степени окисления элемента называют средними, или промежуточными. Например, у атома (элемента) серы высшая степень окисления равна +6, низшая -2, промежуточная +4.
Изменение степеней окисления элементов по группам периодической системы отражает периодичность изменения химических свойств элементов с ростом порядкового номера.
Степень окисления весьма удобно применять при классификации различных веществ, описании их свойств и при рассмотрении окислительно-восстановительных реакций. Докажем это на нескольких примерах. Определив степень; окисления фосфора в кислотах НРО3 (+5), Н3РО4 (+5), Н4Р2О7 (+5) и Н3РO3 (+3), можно сделать вывод, что первые три являются сходными между собой соединениями, так как в них степень окисления фосфора одинакова и равна +5, и по свойствам отличаются от фосфористой кислоты Н3РО3, в которой степень окисления фосфора равна +3.
. Второй пример — окисление SO2 в SO3 и HSO-3 в HSO-4. В обоих случаях степень окисления серы изменяется от +4 до +6, т.е. происходит один и тот же процесс окисления.
Зная степень окисления элемента в соединении, можно предсказать, окислительные или восстановительные свойства проявит это соединение. Так, сера в серной кислоте H2SO4 имеет высшую степень окисления (+6) и, следовательно, больше не может отдавать электронов, а поэтому серная кислота может быть только окислителем. В сероводороде H2S сера, наоборот, имеет низшую степень окисления (-2) и больше не может присоединять
электронов (образован октет), а потому сероводород может быть только восстановителем. Однако сернистая кислота H2SO3 (сера в ней имеет промежуточную степень окисления +4 и может как отдавать, так и присоединять электроны) в зависимости от условий может проявлять как окислительные, так и восстановительные свойства. Подобное заключение можно сделать об однотипных соединениях аналогов серы — селена и теллура. В высшей степени окисления атомы селена и теллура сильно отличаются от атомов со степенью окисления +4 и особенно -2. Это относится к элементам и других подгрупп периодической системы.
Структурные формулы
Состав молекул изображается в виде химических формул: эмпирических, электронных и структурных. В качестве примера напишем соответствующие формулы молекул водорода, воды, аммиака, метана.

Эмпирические, или молекулярные, формулы отражают только качественный и количественный состав молекул, т.е. вид и число атомов в соединении.
Электронные формулы состоят из символов элементов, вокруг которых точками обозначены электроны внешнего уровня, а между атомами — связующие электронные пары. Они показывают порядок соединения атомов в молекуле, а также природу химической связи и механизм образования молекулы из атомов, а потому часто применяются для объяснения поведения соединений в различных реакциях. Две точки между атомами в электронных формулах обозначают места перекрывания электронных облаков, а значит, и наибольшую плотность связующего двух-электронного облака.
Последовательность соединения атомов в молекуле можно представить более наглядно, если каждую связующую электронную пару изобразить черточкой (штрихом). Однако пространственное расположение атомов в молекуле передает лишь структурная формула.
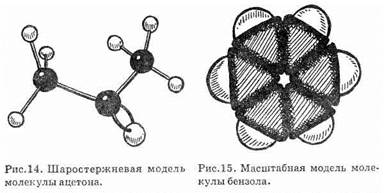
Расположение атомов в пространстве изобразить на рисунке весьма сложно, особенно для молекул с большим числом атомов, но можно показать с помощью моделей — шаростержневых (рис. 14) и масштабных (рис. 15). У первых шарики — атомы соединяются с помощью стержней, символизирующих валентные связи, у вторых пластилиновые шарики вдавлены друг в друга, демонстрируя заполнение пространства молекулы. Обе модели наглядно передают форму молекулы. Модель молекулы метана, где углерод соединен с четырьмя одинаковыми атомами водорода, можно представить в виде тетраэдра (правильного четырехгранника) : в центре его находится атом углерода, в вершинах — атомы водорода. Таким образом, четыре валентности углерода направлены в пространстве к четырем вершинам тетраэдра. Эти направления сохраняются и при образовании углеродных цепей. Молекулу этана можно представить фигурой, состоящей из двух тетраэдров, соединенных вершинами и т.д.
Молекулы некоторых веществ различных классов имеют плоское, а не пространственное строение, поэтому для этих веществ изображение молекулы в виде последовательности соединения атомов совпадает со структурной формулой. В иных случаях, как, например, в молекулах Н2О, NH3 и СН4, изображенная последовательность соединения атомов в молекуле не передает их расположения в пространстве.
Дата добавления: 2016-01-03; просмотров: 2396;
