Химия элементов 11-ой группы – медь, серебро, золото.
В состав одиннадцатой группы периодической системы входят медь 29Cu, серебро 47Ag и золото 79Au, которые иногда называют «монетными металлами», поскольку в древние времена их использовали как деньги, а позже из их сплавов чеканили монету.
Все три металла известны человечеству с глубокой древности. Латинское Cuprum происходит от названия острова Кипр, в рудниках которого римляне добывали медную руду. Первоначально человечество использовало самородную медь – сделанные из такого металла бусы и сверла были обнаружены в Анатолии в ранних неолитических поселениях конца X – начала IX тысчелений до н.э., обитатели которых еще не знали керамику. Красивые красные стекла, окрашенные добавлением в шихту соединений меди, производились римскими ремесленниками задолго до н.э. Серебро и золото, названия которых происходят от слов, описывающих цвет этих металлов (греч. αργος – белый, блестящий и лат. Aurum – желтый), также, по-видимому, использовались на самых ранних стадиях развития общества. В Древнем мире из серебра изготовлялись бусы, перстни, кольца, оно использовалось для чеканки монет и изготовления зеркал. Еще египтяне овладели техникой чернения металла, причем, по сведениям Плиния «ценность серебра возрастает, если его великолепный блеск потускнел». К чернению серебряных изделий прибегали и в более позднее время – в технике черни работали мастера Великого Устюга.
Древнее серебро часто представляло собой сплав с медью и золотом.
Серебряные самородки встречаются в природе значительно реже медных и золотых, поэтому первоначально оно ценилось дороже золота. Цена на серебро понизилась лишь после того, как люди освоили процесс его получения из сульфидных руд. Впервые выплавку серебра из галенита PbS люди освоили в третьем тысячелетии до н.э. В древнем мире основным поставщиком серебра были испанские провинции Римской империи. Серебряную руду, добытую в рудниках, поднимали на поверхность, дробили и обжигали. Процесс получения серебра из свинцовой руды называют купеляцией. По описанию римского географа Страбона, «печи для выплавки серебра...строят высокими, чтобы дым от руды поднимался высоко в воздух, ибо этот дым тяжелый и смертоносный» (Страбон, География, III, 7).
Саородное золото в древности добывали из аллювиальных песков и гравия, образующихся при разрушении золотоносных пород, а также из жил, пронизывающих кварцевые породы. «Золотоносную землю черпают в ручьях и затем промывают поблизости в корытах или роют колодец и моют в нем выброшенную на поверхность земли» (Страбон, География, III, 7). По описанию Плиния Старшего, дробленую золотоносную руду смешивали с ртутью, затем пустую породу отделяли фильтрацией через замшевый фильтр, а золото выделяли из амальгамы путем испарения ртути.
В древности ценился также свело-желтый сплав золота с серебром, называмый элеткрон или электрум. Он тверже золоа, более прочен и мнее подвержен износу.
Как нечетные элементы медь и серебро имеют небольшое количество стабильных изотопов: медь и серебро – по два, а золото – один, что позволило с высокой точностью определить атомную массу элемента (Ar(Au) = 196.96655(2)). Среди изтопов меди преобладает 63Cu (69.09%), в то время как изотопы серебра встречают примерно в равных количествах (51.35 % 107Ag, 48.65% 109Ag).
В основном состоянии атомы элементов 11-ой группы имеют электронную конфигурацию (n-1)d10ns1 (табл. 7.1), в которой валентные электроны расположены на d- и s-орбиталях. Она напоминает электронную конфигурацию щелочных металлов(n-1)s2(n-1)p6ns1, имеющих заполненную р-орбиталь и один внешний s-электрон, и расположенных в коротокопериодном варианте Периодической системы в одной и той же группе с медью, серебром и золотом.. Однако несмотря на некоторое сходство электронных конфигураций химические свойства щелочных металлов и металлов группы меди значительно различаются. Это объясняется тем, что заполненные d10-орбитали в атомах меди, серебра и золота гораздо сильнее экранируют внешние s1-электроны, чем р-орбитали, поэтому у меди и ее аналогов внешний s1-элеткрон сильно связан с ядром, что и обусловливает высокие значения первых энергий ионизации атомов переходных элементов 11-ой группы. Другим следствием этого является уменьшение атмоных радиусов по сравнению с щелочными металлами (например, ион Cu+ имеет радиус 0.093 нм, K+ – 0.133 нм, Na+ – 0.095 нм) и резкое снижение химической актвиности. В то де время вторые энергии ионизации у щелочных металлов оказываются существенно выше, чем у элементов группы меди по причине высокой устойчивости ns2np6-оболочки.
Металлический радиус растет при переходе от меди к серебру, а затем остается неизменным, что объясняется лантаноидным сжатием. Из-за роста радиуса первая энергия ионизации в ряду Cu-Ag уменьшается, но при переходе от Ag к Au увеличивается в связи с ростом заряда ядра при неизменности радиуса, а также из-за релятивистского эффекта, обуславливающего повышенную прочность связи 6s-электронов с ядром. Вторая энергия ионизации оказывается максимальной у серебра, что объясняет его устойчивость в степени окисления +1.
Для элементов группы меди максимальная степень окисления превышает номер группы. В водных растворах для меди характерна степень окисления +2, для серебра +1 и для золота +3. Это согласуется * с последовательностью изменения значений энергий ионизации в группе: первая энергия ионизации оказывается минимальной у серебра, в то время как для меди минимальна сумма двух первых, а для золота – трех первых энергий ионизации. Устойчивость комплексных соединений золота(III) (d8) также вызвана высокой энергией стабилизации кристаллическим полем в плоскоквадратной координации.
Медь(II) преимущественно образует тетрагонально искаженные комплексы, в которых один из электронов находится на dx2-y2 орбитали, имеющей наибольшую энергию. При переходе к серебру и далее к золоту параметр расщепления возрастает на 80%, и энергия dx2-y2 орбитали повышается настолько, что девятый электрон значительно легче оторвать, в случае анома меди. Это приводит к тому, что существование ионов Ag2+ и Au2+ становится энергетически невыгодным.
Таблица 7.1.
Некоторые свойства атомов элементов 11-ой группы.
| Свойства | Cu | Ag | Au |
| Заряд ядра | |||
| Число стабильных изотопов | |||
| Электронная конфигурация | [Ar]3d104s1 | [Kr] 3d105s1 | [Xe]4f145d106s1 |
Металлический радиус, 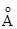 (К.Ч.=12) (К.Ч.=12)
| 1.28 | 1.44 | 1.44 |
| Первая энергия ионизации, кДж/моль | 745.3 | 730.8 | 889.9 |
| Вторая энергия ионизации, кДж/моль | 1957.3 | 2072.6 | 1973.3 |
| Третья энергия ионизации, кДж/моль | 3577.6 | 3359.4 | |
Ионные радиусы **, 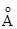 M(I) M(I)
| 0.77 | 1.15 | 1.37 |
Ионные радиусы, 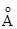 M(II) M(II)
| 0.73 | 0.94 | – |
Ионные радиусы, 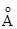 M(III) M(III)
| 0.54 | 0.75 | 0.85 |
| Электроотрицательность по Полингу | 1.90 | 1.93 | 2.54 |
| Электроотрицательность по Оллреду-Рохову | 1.75 | 1.42 | 1.42 |
| Сродство к электрону, кДж/моль для КЧ = 6 | |||
| Степени окисления | 0, I, II, (III), (IV) | 0, I, II, (III), (IV),(V) | –1, 0, III, (V), (VII) |
Дата добавления: 2016-01-03; просмотров: 4550;
