Квантово-механическая модель строения атома.
Строение атома и периодическая система.
Квантово-механическая модель строения атома.
Атом состоит из ядра  и электронов (
и электронов (  ). В состав ядра входят протоны (
). В состав ядра входят протоны ( 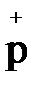 ) и нейтроны (
) и нейтроны ( 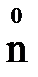 ). Например, в атоме железа
). Например, в атоме железа 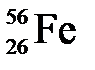 содержится протонов 26, электронов 26, нейтронов 30 (56-26=30).
содержится протонов 26, электронов 26, нейтронов 30 (56-26=30).
Современная теория строения атома основывается на законах, описывающих поведение микрообъектов – микрочастиц (электронов, протонов, нейтронов и др.), которые рассматриваются в квантовой или волновой механике. Отличают её от классической механики, изучающей макрообъекты (тела нашего окружения), идеи о корпускулярно-волновом дуализме и вероятностном характере законов микромира.
В основе квантовой теории строения атома лежат следующие положения:
1.Электрон имеет двойственную (корпускулярно-волновую) природу. Как частица (корпускула) он обладает массой и зарядом, а движущийся электрон характеризуется способностью к дифракции и интерференции. Длина волны электрона ( 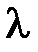 ), вычисленная по формуле де Бройля, соизмерима с размерами атома
), вычисленная по формуле де Бройля, соизмерима с размерами атома
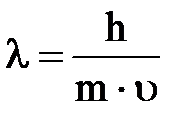 ,
,
h – постоянная Планка, m – масса частицы, 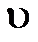 - скорость.
- скорость.
2.Для электрона, обладающего волновыми свойствами, невозможно одновременно точно измерить координату и скорость (Принцип неопределённости Гейзенберга).
3.Электрон в атоме движется не по определённым траекториям, а может находиться в любой части околоядерного пространства с различной степенью вероятности. Область наиболее вероятного нахождения электрона в атоме называется электронным облаком.
Часть электронного облака, в которой вероятность нахождения электрона достаточно велика (> 90%) называется атомной или электронной орбиталью (А.О.).
S облака имеют форму шара; р облака – форму в виде гантели; d облака – четырехлопастный цветок.
Форма и размер атомной орбитали определяют на основании значений квантовых чисел (n, 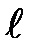 ,
, 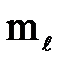 , ms), которые получают при решении уравнения Шредингера, имеющего сложный математический аппарат.
, ms), которые получают при решении уравнения Шредингера, имеющего сложный математический аппарат.
Квантовые числа и их характеристика.
Главное квантовое число (n) характеризует запас энергии электрона на энергетическом уровне и удалённость уровня от ядра. Оно соответствует номеру периода в периодической системе и принимает значения целых чисел, практически до семи.
Значения главного → численные 1 2 3 4 5 6 7
квантового числа (n) → буквенные K L M N O P Q
Орбитальное квантовое число ( 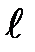 ) характеризует энергетический подуровень: запас энергии электронов на подуровне и форму электронного облака. Принимает значение от 0 до n-1.
) характеризует энергетический подуровень: запас энергии электронов на подуровне и форму электронного облака. Принимает значение от 0 до n-1.
Значения орбитального → численные 0 1 2 3
квантового числа ( 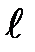 ) → буквенные s p d f
) → буквенные s p d f
Магнитное квантовое число ( 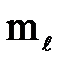 ) характеризует ориентацию орбиталей в пространстве. Принимает значения от -
) характеризует ориентацию орбиталей в пространстве. Принимает значения от - 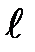 до +
до + 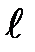 через ноль.
через ноль.
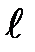 = 0,
= 0, 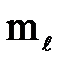 = 0 - s подуровень
= 0 - s подуровень
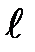 = 1,
= 1, 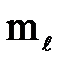 = -1, 0, +1 - p подуровень
= -1, 0, +1 - p подуровень
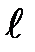 = 2,
= 2, 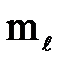 = -2, -1, 0, +1, - d подуровень
= -2, -1, 0, +1, - d подуровень
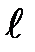 = 3,
= 3, 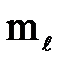 = -3, -2, -1, 0, +1, +2, +3 - f подуровень
= -3, -2, -1, 0, +1, +2, +3 - f подуровень
Спиновое квантовое число (ms) характеризует способность движения электрона вокруг собственной оси. Оно принимает два значения:
+ 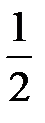 - по часовой стрелке (↑)
- по часовой стрелке (↑)
- 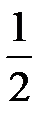 - против часовой стрелки (↓)
- против часовой стрелки (↓)
На основании значений квантовых чисел устанавливается предельная ёмкость уровней.
Предельная емкость уровней:
| Номер энергетического уровня | ||||
| Буквенное обозначение уровня | K | L | М | N |
| Буквенное обозначение подуровня | s | s, p | s, p, d | s, p, d, f |
| Число электронов на подуровне | 2,6 | 2,6,10 | 2,6,10,14 | |
| Число электронов на уровне |
Правила заполнения орбиталей электронами:
1. Принцип наименьшей энергии – сначала заполняются орбитали с самой низкой энергией, которые наиболее ближе к ядру.
2. Принцип Паули – на каждой орбитали помещается не более двух электронов, имеющих противоположные (антипараллельные) спины E .
3. Правило Хунда – электроны в пределах подуровня распределяются таким образом, чтобы неспаренных электронов было больше.
В зависимости от того, какой подуровень завершается, все элементы периодической системы делятся на четыре электронных семейства:
s-элементы – элементы групп IА, IIА, водород, гелий;
p-элементы – элементы групп III A – VIII A, кроме водорода и гелия;
d-элементы – элементы побочных подгрупп;
f-элементы – лантаноиды и актиноиды.
В периодической системе номер периода указывает на число энергетических уровней, а номер группы - на число валентных электронов.
2. Особенности заполнения электронами электронных оболочек у атомов элементов главных и побочных подгрупп.
У элементов главных подгрупп (s- и р-элементов) завершается последний энергетический уровень. Все валентные электроны у них находятся на последнем уровне.
У элементов побочных подгрупп (d-элементов) завершается предпоследний энергетический уровень, а на последнем уровне, как правило, находится два электрона. Валентные электроны находятся на последнем уровне (два) и на завершаемом d-подуровне остальные.
3. Периодический закон
Свойства химических элементов, а также формы и свойства соединений элементов находятся в периодической зависимости от зарядов ядер их атомов (современная формулировка Периодического закона).
Причина периодичности – периодическое изменение строения внешних электронных слоев атомов.
Периодическая таблица – это графическое табличное отражение Периодического закона. Периодическая система основана на закономерностях, проявляемых в горизонтальных и вертикальных рядах.
Период – это горизонтальный ряд элементов, расположенных в порядке возрастания зарядов атомных ядер (протонов в ядре), начинающийся щелочным металлом и завершающийся инертным газом. В периодах с ростом зарядов атомных ядер усиливается притяжение электронов к ядру, возрастает способность электрона принимать, т.е. усиливаются неметаллические (окислительные) свойства, а металлические (восстановительные) свойства ослабевают.
Группа – это ряд элементов, объединенных по признаку высшей степени окисления в оксидах. Отсюда следует, что номер группы, как правило, указывает на число электронов, которые могут участвовать в образовании химических связей. В группах сверху вниз увеличивается число энергетических уровней в атоме, валентные электроны отодвигаются от ядра дальше и слабее к нему притягиваются. Поэтому металлические свойства усиливаются, а неметаллические ослабевают.
Группы делятся на подгруппы: главные (группы А) и побочные (группы В). В подгруппах находятся электронные аналоги, т.е. элементы, имеющие одинаковую конфигурацию внешних электронных слоев. В группах А – s- и p-элементы, а в группах В – d- и f-элементы.
4. Периодические свойства атомов элементов.
Радиус атома – важнейшая характеристика атома. Чем больше атомный радиус, тем слабее удерживаются внешние электроны и наоборот. Радиус атома по Ван – дер – Вальсу – это половина кратчайшего расстояния, на которое могут сблизиться ядро двух атомов, сферы которых соприкасаются.
В периодах атомные радиусы слева направо уменьшаются. Это объясняется ростом силы притяжения электронов с ростом зарядов их атомных ядер. Вподгруппах сверху вниз атомные радиусы возрастают, так как увеличивается число электронных слоев.
Энергия ионизации – это энергия, необходимая для отрыва наиболее слабо связанного электрона от атома. Она является мерой металличности (восстановительных) свойств. Возрастает по периодам и уменьшается в группах. Наименьшая энергия ионизации у франция.
Сродством к электрону называется энергетический эффект при присоединении к атому одного электрона. Изменяется по периодам и группам, также как и энергия ионизации. Является мерой неметалличности (окислительных) свойств. Наибольшее сродство к электрону у фтора.
Электроотрицательность (ЭО) – есть способность атома данного элемента в соединениях притягивать к себе электроны, участвующие в образовании химической связи.
Широко распространена относительная школа электроотрицательностей (ОЭО), введенная Л.Полингом, в которой Э.О. фтора принята равной четырем. Электроотрицательности с ростом порядкового номера элемента увеличивается в периодах и уменьшается в группах.
| <== предыдущая лекция | | | следующая лекция ==> |
| Корпоративные модульные концентраторы | | | СПОСОБЫ ПОЛУЧЕНИЯ ИНФОРМАЦИИ О БОЛЬНОМ |
Дата добавления: 2016-01-03; просмотров: 6477;
