Лекция №14: Растворы. Способы выражения их концентрации.
Еще в средние века алхимикам хорошо было известно правило: “Similia similibus solvuntur”, что означает “Подобное растворяется в подобном”. В описаниях химических процессов они всегда указывали концентрации и способы приготовления исходных растворов. Растворами называют гомогенные фазы, состав и свойства которых может изменяться в определенных, часто весьма широких пределах. Все газовые смеси, включая воздушную атмосферу, являются истинными растворами со свойствами, близкими к идеальным.
Систематическое изучение свойств растворов в зависимости от их составов началось лишь во второй половине XIX-го века. Так своё исследование, выполненное в 1861г. молодой Д.И. Менделеев представил в качестве докторской диссертации на тему “О соединении спирта с водой”. В этой работе Д.И. Менделеев тщательно измерил удельные объемы водно-этаноль-ных растворов и обнаружил на их производных по концентрации экстремумы, отвечающие гидратам спирта целочисленного состава. На этом основании Д.И. Менделеев обосновал так называемую химическую точку зрения на растворы, в соответствии с которой все растворы рассматривались как смеси различных соединений растворителя и растворенного вещества.
Полярно противоположная точка зрения на растворы, получившая название физической теории растворов, была развита в работах целой плеяды скандинавских физико-химиков: Я. Х. Вант-Гофф, С.А. Аррениус, В. Ф. Оствальд и др.
Якоб Вант-Гофф пришел к выводу о полной аналогии свойств разбавленных растворов свойствам газов, о применимости к ним основных газовых законов и распространил эти представления на твердые растворы. Тем самым он полностью отрицал химические взаимодействия между компонентами растворов.
Сванте Аррениус в 1887г. разработал и всесторонне обосновал теорию электролитической диссоциации, основные положения которой не потеряли своей актуальности до настоящего времени.
Вильгельм Оствальд в 80-х годах XIX-го века развил основные положения теории электролитической диссоциации и создал на ее основе теорию кислотно-основного катализа водородными и гидроксильными ионами. Таким образом, к концу прошлого века была создана теория разбавленных растворов электролитов.
Независимо друг от друга два российских физико-химика И.А. Каблуков и В.А. Кистяковский в 1891г. выдвинули идею об особых видах взаимодействия между ионами и молекулами растворителя. Это явление получило название сольватации (в случае воды - гидратации).
Концентрация растворов выражается отношением массы, числа молей или числа эквивалентов растворенного вещества, приходящегося на массу, общее количество молей или объем всего раствора или только растворителя. Растворенными веществами при одинаковом агрегатном состоянии компонентов обычно считаются компоненты, находящиеся в недостатке, в то время как компонент, находящийся в избытке, считается растворителем. При разных агрегатных состояниях компонентов раствора растворителем обычно считается компонент, агрегатное состояние которого совпадает с агрегатным состоянием раствора. Например, в случае жидких растворов твердых и газообразных веществ растворителем всегда считается жидкий компонент, независимо от концентрации растворенных веществ, которая часто превышает 50 масс.%.
Из определения видно, что способов выражения концентрации раствора может быть не менее 18. Однако практическое применение в технике и лабораторной практике нашли лишь следующие способы:
1. Процентная концентрация – отношение массы растворенного вещества mв к общей массе раствора mS:
С%= 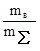 ·100%.
·100%.
Например, 20% раствор Na2SO4 содержит 20 г Na2SO4 и 80 г H2O.
Этот способ широко распространен в технике и в быту ввиду удобства приготовления, разбавления растворов, а также практических расчетов и пересчетов в другие способы выражения концентрации. Недостатком метода является необходимость пересчета в мольные способы выражения концентрации при аналитических и стехиометрических расчетах по химическим формулам веществ и схемам химических реакций.
2. Молярная концентрация (молярность) – число молей растворенного вещества nв, содержащихся в объёме раствора:
СМ=М= 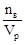 [моль/м3 или моль/л], где Vp – объём раствора, м3 или л.
[моль/м3 или моль/л], где Vp – объём раствора, м3 или л.
Пример: 1М раствор H2SO4 содержит в каждом литре 1 моль Н2SO4 или 98г.
Это наиболее распространенный способ выражения концентрации жидких растворов в аналитической и препаративной химии, так как он предполагает быстрое приготовление растворов в мерных колбах путем добавления растворителя к определенному количеству известного раствора (так называемой аликвоте) до некоторого фиксированного объема. К недостаткам метода следует отнести низкую точность приготовления растворов (измерение объемов обычно производится с точностью в несколько процентов, в то время как взвешивание имеет точность не хуже сотых долей процентов), а также изменение молярности приготовленных растворов с изменением температуры ввиду их термического расширения.
3. Нормальная концентрация (нормальность) – число эквивалентов растворенного вещества 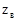 , содержащихся в объёме раствора
, содержащихся в объёме раствора 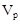 :
:
СН=Н= 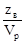 [г-экв/м3 или г-экв/л].
[г-экв/м3 или г-экв/л].
Пример: 1Н раствор H2SO4 содержит в каждом литре 1 эквивалент или 49 г Н2SO4.
По сравнению с молярностью нормальность раствора имеет то важное преимущество, что при одинаковых нормальностях реагирующих растворов объемы реагирующих растворов всегда равны, так как содержат одинаковое количество эквивалентов, а вещества реагируют в эквивалентных отношениях. Вместе с тем, нормальности растворов годятся только для однотипных реакций, так как каждое вещество имеет различные эквиваленты в различных реакциях.
4. Моляльная концентрация (моляльность) - число молей растворенного вещества nв, содержащихся в 1кг растворителя ( 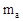 =1кг=1000г):
=1кг=1000г):
Сm=m= 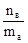 [моль/кг или моль/1000 г].
[моль/кг или моль/1000 г].
Пример: 1m водный раствор H2SO4 содержит в каждом килограмме воды 1моль Н2SO4 (или 98 г Н2SO4).
Этот способ выражения концентрации широко применяется в теории растворов, особенно растворов электролитов, ввиду его независимости от температуры и возможности приготовления растворов с высокой точностью выражения концентрации. По этим причинам все современные справочники по растворам электролитов обычно используют моляльный способ выражения концентрации. Вся стандартизация электродных потенциалов, рН, активностей, растворимостей и других термодинамических свойств растворов приведена к единице моляльности. К недостаткам способа относится необходимость пересчета количества вещества, приходящегося на 1 кг растворителя, на массу или объем всего раствора.
5. Мольная доля – отношение числа молей растворенного вещества nв к общему количеству молей раствора nS:
Np= 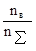 , где nS=nв+nа, где nа – число молей растворителя.
, где nS=nв+nа, где nа – число молей растворителя.
Пример: водный раствор H2SO4 с молярной долей 0,2 содержит 1 моль Н2SO4 и 4 моль H2O.
Этот способ выражения концентрации широко распространен в физической химии, так как прямо указывает на концентрацию частиц компонента в смеси частиц, независимо от природы и массы самих частиц. К недостаткам метода следует отнести крайне низкие численные значения ввиду обычно наблюдающегося огромного избытка легких молекул растворителя в практической области концентраций, а также неудобство при практическом применении, связанное с необходимостью пересчета в единицы массы через соответствующие молекулярные массы.
Дата добавления: 2015-12-26; просмотров: 1479;
