Растворимость в бинарной системе соль - вода
В этом случае, согласно уравнению (1), [Mz+]=n+S и [Az-]=n-S.
Подставим эти соотношения в (2). L=(n+S)n+(n-S)n-×g±n. После преобразования получим: L=(n±g±S)n, где среднеионный стехиометрический коэффициент равен: n±=(n+n+×n-n-)1/n, а n++n-=n.
Отсюда получаем формулу для расчета растворимости соли в воде:
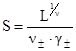 (5)
(5)
Если растворимость соли ниже 10-4 моль/л, то среднеионный коэффициент активности можно принять равным 1.
Растворимость в многокомпонентной системе в отсутствие
Одноименного иона
Одноименными называют ионы, входящие в состав рассматриваемого труднорастворимого соединения. Если таковые в многокомпонентном растворе отсутствуют, то расчет растворимости ведут также по формуле (5), но с учетом ионной силы раствора. Вкладом труднорастворимого соединения в ионную силу пренебрегают, если его растворимость более, чем в 100 раз ниже концентрации других компонентов раствора. Ионную силу вычисляют как 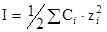 , а коэффициент активности как
, а коэффициент активности как 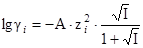 или
или 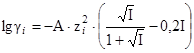 , подставляя в последние вместо квадрата заряда иона модуль произведения зарядов ионов, образующихся при растворении труднорастворимой соли.
, подставляя в последние вместо квадрата заряда иона модуль произведения зарядов ионов, образующихся при растворении труднорастворимой соли.
Следует подчеркнуть, что с ростом ионной силы g± при не высоких концентрациях электролита понижается, а растворимость увеличивается.
Дата добавления: 2015-12-26; просмотров: 1311;
