Методические основы анализа термодинамических процессов
К основным процессам, имеющим большое значение как для теоретических исследований, так и для практических работ в технике, относятся:
- изохорный, протекающий при постоянном объеме;
- изобарный, протекающий при постоянном давлении;
- изотермический, протекающий при постоянной температуре;
- адиабатный, протекающий при отсутствии теплообмена с внешней средой.
Кроме того, существует группа процессов, являющихся при определенных условиях обобщающими для основных процессов. Эти процессы называются политропными.
Для всех процессов принят общий метод исследований, который заключается в следующем:
а) выводится уравнение процесса, устанавливающее связь между начальными и конечными параметрами рабочего тела в данном процессе;
б) вычисляется работа изменения объема рабочего тела;
в) определяется количество теплоты, участвующее в процессе;
г) определяется изменение внутренней энергии, энтальпии и энтропии рабочего тела в исследуемом процессе;
д) строиться схема превращения энергий в термодинамическом процессе согласно основному уравнению первого закона термодинамики.
А.С.Ястрежембским был предложен весьма наглядный способ графической интерпретации превращения энергии в термодинамических процессах. Для этого вводятся следующие обозначения энергетических составляющих согласно первому закону термодинамики:



 - количество теплоты q, подводимое или отводимое от термодинамической системы, - изменение внутренней энергии системы Du, - совершенная или затраченная системой работа l.
- количество теплоты q, подводимое или отводимое от термодинамической системы, - изменение внутренней энергии системы Du, - совершенная или затраченная системой работа l.
В качестве примера на рис. 4.1 показано взаимное расположение всех составляющих основного уравнения первого закона термодинамики.
Штриховка указывает на то, что данная составляющая претерпевает изменение в процессе, а направление взаимного превращения всех энергетических факторов дается стрелками.
На схеме, изображенной на рис. 4.1, показано, что вся теплота q, подводимая к рабочему телу из окружающей среды, идет на изменение внутренней энергии системы Du, а внешняя работа деформации не претерпевает никаких изменений, т.е. в этом процессе l = 0.
При исследовании термодинамических процессов принимается, что все процессы равновесны и обратимы, теплоемкость рабочего тела – величина постоянная для любой точки процесса с = const.
В любом термодинамическом процессе согласно первому закону термодинамики теплота q, подводимая к рабочему телу из окружающей среды, идет на изменение внутренней энергии Du и совершение работы l.
Коэффициентом распределения теплоты y называется отношение изменения внутренней энергии Du к количеству теплоты q, подводимого к рабочему телу, при осуществлении термодинамического процесса:
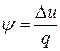 .
.
Следовательно, на изменение внутренней энергии идет часть теплоты:
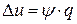 ,
,
а на механическую работу пойдет другая часть количества теплоты:
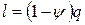 .
.
Причем коэффициент распределения теплоты для определенного термодинамического процесса есть величина постоянная: y = const.
Адиабатный процесс
Процесс, протекающий без подвода и отвода теплоты, т.е. при отсутствии теплообмена рабочего тела с окружающей средой, называется адиабатным, следовательно, dq = 0 Þ q = 0.
Выведем уравнение адиабаты. Из уравнения первого закона термодинамики при dq = 0 имеем:
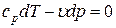 или
или 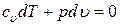 .
.
Разделив первое уравнение на второе, получим:
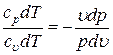 Þ
Þ 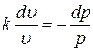 ,
,
где 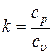 - показатель адиабаты, который определяется числом степеней свободы молекулы. Для одноатомного газа k = 1,66, для двухатомного k = 1,44, для трех- и многоатомных k = 1,33.
- показатель адиабаты, который определяется числом степеней свободы молекулы. Для одноатомного газа k = 1,66, для двухатомного k = 1,44, для трех- и многоатомных k = 1,33.
Интегрируя последнее уравнение при условии, что k = const, находим:
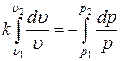 Þ
Þ 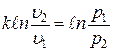 .
.
После потенцирования имеем:
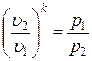 Þ
Þ 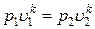 .
.
Следовательно, уравнение адиабаты при постоянном отношении теплоемкостей имеет вид:
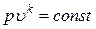 .
.
Для показателя адиабаты справедливо также следующее выражение:
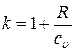 ,
,
так как 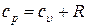 - уравнение Майера.
- уравнение Майера.
Рассмотрим зависимость между основными параметрами в адиабатном процессе. Из уравнения адиабаты следует, что
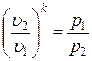 Þ
Þ 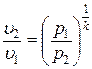 .
.
Если это соотношение параметров тела подставить в уравнение состояния для крайних точек процесса:
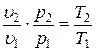 ,
,
то после соответствующих преобразований найдем:
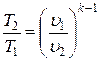 ;
; 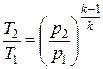 .
.
Поскольку k > 1, то в координатах р, u линия адиабаты идет круче линии изотермы: при адиабатном расширении давление понижается быстрее, чем при изотермическом, так как в процессе расширения уменьшается температура газа.
Графики процесса в рu и Ts – диаграммах представлены на рис 4.2.
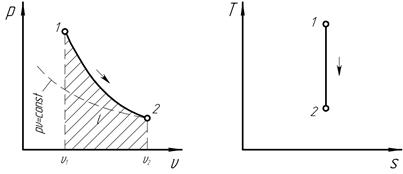
Рис. 4.2. Графики термодинамического процесса при s = const.
Работа расширения при адиабатном процессе согласно первому закону термодинамики совершается за счет уменьшения внутренней энергии и может быть вычислена по одной из следующих формул:
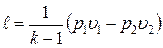 ; ;
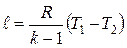
| 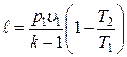
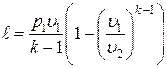 ; ;
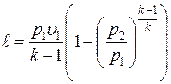 ; ;
|
Изменение внутренней энергии:
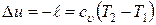 .
.
 Поскольку при адиабатном процессе dq = 0, энтропия рабочего тела не изменяется (ds = 0 и s = const). Следовательно, адиабатный процесс является одновременно изоэнтропным и изображается в T, s – диаграмме вертикальной прямой (рис. 4.2).
Поскольку при адиабатном процессе dq = 0, энтропия рабочего тела не изменяется (ds = 0 и s = const). Следовательно, адиабатный процесс является одновременно изоэнтропным и изображается в T, s – диаграмме вертикальной прямой (рис. 4.2).
Схема распределения энергии в адиабатном процессе представлена на рис. 4.3.
Дата добавления: 2015-11-26; просмотров: 1383;
