Состав «идеального» белка
«Идеальный» белок – условное понятие, обозначающее белок, по сбалансированности аминокислотного состава наиболее полно отвечающее потребностям организма человека.
В 1973 г Всемирной организацией здравоохранения (ВОЗ) принят состав «идеального» белка, в 1 г которого содержание незаменимых аминокислот составляет:
| Изолейцин | 40 мг | Фенилаланин | 60 мг |
| Лейцин | 70 мг | Треонин | 40 мг |
| Лизин | 55 мг | Триптофан | 10 мг |
| Метионин + цистеин | 35 мг | Валин | 50 мг |
Биологическая ценность белков пищевых продуктов определяется содержанием незаменимых аминокислот. Показатель, получаемый при сравнении содержания отдельной незаменимой аминокислоты в белке пищи с ее содержанием в «идеальном» белке, называют аминокислотным скором:
АК = 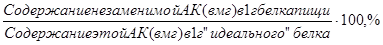
Аминокислота с минимальным скором называется лимитирующей. Лимитирующая аминокислота определяет биологическую ценность белка. Если в составе белка лимитирующими являются несколько аминокислот, то биологическая ценность белка определяется аминокислотой, скор которой наименьший.
По сбалансированности аминокислотного состава идеальному белку наиболее близки белки животного происхождения. Биологическая ценность растительных белков ниже, т.е. растительные белки по сбалансированности аминокислотного состава не соответствуют «идеальному» белку.
Наряду с аминокислотным составом биологическая ценность белков определяется также и степенью их усвоения после переваривания. Животные белки имеют более высокую усваиваемость, чем растительные. В порядке убывания скорости усвоения белков в желудочно-кишечном тракте пищевые продукты располагаются следующим образом:
рыба > молочные продукты > мясо >хлеб >крупы
Одной из причин более низкой усваиваемости растительных белков является их взаимодействие с полисахаридами (целлюлозой, гемицеллюлозами), которые затрудняют доступ пищеварительных ферментов к полипептидам.
Белки мяса
Мясо представляет собой комплекс мышечной, соединительной, жировой, костной тканей, крови, мозга, печени, сердца, субпродуктов и др. Наиболее ценной в пищевом отношении является мышечная ткань. Мышечная ткань составляет свыше 40% массы тела животного.
У животных имеется более 300 видов мышц, они подразделяются на две группы:
а) Гладкие мышцы. Сюда относятся мышцы желудка, кишечника, пищевода, селезенки и др. органов, делающих ритмичные непроизвольные движения.
б) Поперечно-полосатые мышцы, совершающие произвольные движения.
Мускулатурой особого смешанного типа являются мышцы сердца.
Наибольшую пищевую ценность представляет поперечно-полосатая мышечная ткань. Она основа мяса, обладает превосходными вкусовыми и питательными качествами, легко усваивается организмом человека. По сбалансированности аминокислотного состава белки поперечно-полосатой мышечной ткани наиболее близки к «идеальному» белку. Говядина, свинина и баранина в этом отношении мало отличаются друг от друга.
Главными мышечными белками являются актини миозин. Миозин составляет 56% мышечной ткани, актин – 25%. Молекулярная масса миозина около 460000 Да, актина – 43000 Да. Актин и миозин являются фибриллярными белками, поэтому их называют миофибриллами.
Основной белок соединительной ткании хрящей коллаген является неполноценным белком, потому что не содержит незаменимую аминокислоту триптофан. Близкий по свойствам к коллагену белок – эластин. Он содержится в связках и стенках кровеносных сосудов. Эластин богат глицином, аланином и лизином, но беден пролином.
Миоглобин
В мышечной ткани содержится сложный белок миоглобин, который ответственен за розовую окраску мяса. Миоглобин аналог протеида крови гемоглобина. Гемоглобин транспортирует кислород по кровеносным сосудам и передает его миоглобину, находящемуся в тканях. Миоглобин хранит кислород до тех пор, пока не потребуется для биохимической реакции в клетках.
Небелковой частью миоглобина является хромофорная группа (гем), содержащее двухвалентное железо. Миоглобин имеет повышенную склонность к образованию окрашенных комплексных соединений с различными газами: О2, NO, CO, H2S.
С технологической и товароведческой точек зрения превращения, в результате которого мясо теряет красный цвет, нежелательны. Закрепление цвета во многих случаях – основная цель технологических приемов обработки. С целью закрепления красного цвета при изготовлении мясных продуктов (сосисек, сарделек, вареных и копченых колбас, ветчины и др.) в фарш добавляют нитриты и нитаты: КNО2 (Е-249), NаNО2 (Е-250) и NаNО3 (Е-251). Добавляют не более 0,01%. Миоглобин переходит в очень устойчивый нитрозомиоглобин, который после денатурации белковой части (глобина) переходит в розовый нитрозомиохром.
Однако использование нитритов и нитратов для закрепления розового цвета мяса нежелательно. Нитриты, добавленные в мясные продукты, могут реагировать с аминными и иминными группами белков, в результате чего образуются разнообразные нитрозамины. Установлено, что более 100 из них обладают канцерогенным действием.
Больше всего нитрозаминов обнаружено в копченых мясных изделиях, колбасах, приготовленных с добавлением нитритов, - до 80 мкг/кг, в соленой и копченой рыбе – 110 мкг/кг, в сырах, прошедших фазу ферментации – до 10 мкг/кг, в пиве – до 12 мкг/л.
Дата добавления: 2015-12-22; просмотров: 14288;
