Принимая форму каната, придает сухожилиям прочность на разрыв.
НЕМИНЕРАЛИЗОВАННАЯ СОЕДИНИТЕЛЬНАЯ ТКАНЬ
Ткани организма человека состоят из клеток и внеклеточного пространства, которое называется внеклеточный (межклеточный) матрикс. Ткань, в которой внеклеточный матрикс занимает значительно больший объем, чем клетки называется соединительнойтканью. Рис.11.1.
Доля соединительной ткани в разных органах различна, в коже, костях – она является основным компонентом. Соединительная ткань:
● образует твердые, как камень, кости и зубы;
● формирует прозрачное вещество роговицы глаза;
принимая форму каната, придает сухожилиям прочность на разрыв.
ХИМИЧЕСКИЕ МАКРОМОЛЕКУЛЫ СОЕДИНИТЕЛЬНОЙ ТКАНИ
Макромолекулы синтезируются и секретируются клетками соединительной ткани: фибробластами, хондробластами (хрящ), остеобластами (кость), цементоцитами (цемент).
Матрикс неминерализованной ткани образуют макромолекулы двух основных классов:
• полисахариды - гликозамингликаны (ГАГ)
- в свободном состоянии;
- или ковалентно связанные с белком.
• фибриллярные белки двух типов:
- структурные коллаген и эластин;
- адгезивные, например, фибронектин, ламинин, нидоген.
■ ГАГ и протеогликаны образуют гидратированную гелеподобную среду, в которую погружены фибриллярные белки;
■ Коллагеновые волокна организуют порядок и укрепляют матрикс, эластические структуры придают ему упругость;
■ Адгезивные белки взимодействуя с клетками, коллагеном и ГАГ обеспечивают интеграцию компонентов матрикса.
ГЛИКОЗАМИНГЛИКАНЫ.
Гликозамингликаны (ГАГ) – это длинные неразветвленные полисахаридные цепи, состоящие из повторяющихся дисахаридных звеньев -[А-В]n-. Все сахара синтезируются из глюкозы.
В дисахариде:
♦ один остаток – аминосахар N-ацетилглюкозамин или N-ацетилгалактозамин, который у многих ГАГ сульфатирован;
♦ другой - глюкуроновая кислота.
-SO3-- и –COO--группы придают ГАГ большой отрицательный заряд.
В матриксе различают 4 главные группы ГАГ:
· гиалуроновая кислота;
· хондроитинсульфат и дерматансульфат;
· гепарансульфат и гепарин;
· кератансульфат.
СИНТЕЗ ГЛИКОЗАМИНГЛИКАНОВ.
 Все ГАГ за исключение гиалуроновой кислоты (ГК) связаны с белком и образуют
Все ГАГ за исключение гиалуроновой кислоты (ГК) связаны с белком и образуют
протеогликаны (ПГ).
 ГАГ – 95% Белковая часть - 5%
ГАГ – 95% Белковая часть - 5%
Сердцевинный белок (белковая часть) ПГ образуется на рибосомах ЭР, а синтез цепей ГАГ идет, в аппарате Гольджи. Синтез ГАГ начинается с присоединение к остатку серина в белке ксилозы, галактозы, галактозы с образованием трисахарида. Рис.11.2.
Специфические гликозилтрансферазы присоединяют повторяющихся дисахаридные единицы (А и В). Синтез гиалуроновой кислоты (ГК) катализируют гиалуронатсинтетазы - ферменты клеточной мембраной фибробластов. По мере роста цепи ГК выводится из клетки и могут с помощью гиалуронат-связывающих белков участвовать в образовании агрекана.
Синтез протеогликана – хондроитинсульфата рис.11.3
В сульфатировании участвует ФАФS (3′-фосфоаденозин-5′-фосфосульфат).
Синтезированные протеогликаны выходят из клетки, они различаются по:
• содержанию белка;
• длине полисахаридных цепей;
• числу и типу гликозамингликановых цепей в молекуле.
Структура – «мономера» протеогликана
В межклеточном пространстве ПГ могут образовывать гигантские агрегаты с участием ГК. Они могут удерживать более сотни протеогликановых «мономеров» с помощью связующих белков.
Строение агрекана хрящевого матрикса Рис.11.5.
Агрекан хрящевого матрикса содержит ~ 100 цепей хондроитинсульфата и ~ 60 цепей кератансультата. Отрицательно заряженные группы полисахаридных цепей связывают много ионов: Na+, Са2+, К+, которые удерживают воду во внеклеточном матриксе.
Комплексы из ПГ и коллагенов в позвоночных и суставных дисках:
■ повышают их устойчивость к ударам;
■ смягчают трение возникающее между костями.
Диски сдавливаются в течение дня, восстанавливают эластичность ночью, но постепенно деформируются с возрастом.
Рессорная функция гликозамингликанов. Рис.11.6.
Катаболизм гликозамингликанов.
Распад ГАГ и ПГ происходит в лизосомах под действием гидролаз (протеаз, кислых гликозидаз и сульфатаз). Нарушение процесса распада приводит к накоплению в лизосомах фрагментов ГАГ и развитию лизосомальных болезней.
КОЛЛАГЕНЫ составляют около 30% от общего белка организма человека. Молекулы коллагенов имеют трехспиральную структуру, образованную скручиванием трех пептидных α-цепей, которые содержат от 600 до 3000 аминокислот.
Аминокислотный состав α-цепей коллагена.
Цепь состоит из повторяющихся триплетов –[Гли-Х-Y]n- , где Х и Y могут быть любыми аминокислотами, но чаще всего Х – это пролин, а Y – гидроксипролин. Глицин, не имеющий радикала, допускает плотную укладки трех полипептидных цепей.
Коллаген содержит, в основном, заменимые аминокислоты, поэтому является неполноценным белком.
Этапы синтеза и формирования фибрилл коллагена.
Весь процесс протекает в два этапа. Первый – внутриклеточный идет на полирибосомах, поэтому одновременно образуется много молекул пре-про-α-цепей коллагена.
• отщепление «сигнального» пептида;
С помощью N-концевого «сигнального» пептида пре-про-α-цепи молекулы белка переносятся в просвет ЭР. После этого «сигнальный» пептид отщепляется и образуется про-α-цепь.
• гидроксилирование аминокислотных остатков пролина и лизина
происходит в полости ЭР под действием железосодержащих (Fe2+) ферментов пролилгидроксилазы и лизилгидроксилазы. В ходе реакций Fe2+ окисляется (Fe3+), в его восстановлении участвует вит. С. Рис.11.9.
Введение ОН- группы в гидрофобный радикал Про позволяет гидПро образовывать водородные связи, стабилизирующие трехспиральную структуру коллагена. Лизин и гидроксилизин в ходе внеклеточного этапа образуют ковалентные связи при сборке коллагеновых фибрилл.
• гликозилирование гидроксилизина катализируют специфические гликозилтрансферазы. Они могут присоединять остатки галактазы, галактозы и глюкозы. По завершении спирализации гликозилирование прекращается.
Гликозилирование аминокислотных остатков гидроксилизина. Рис.11.10.
Остатки Цис в N (100 ам-т)- и С-концевых (250 ам-т) фрагментах:
■ обеспечивают правильную ориентацию 3-х про-α-цепей относительно друг друга;
■ образуя меж- и внутрицепочечные дисульфидные мостики мешают спирализации N- и С-концов.
■ предотвращают образование крупных коллагеновых фибрилл в клетках.
Образованные структуры из трех про-α-цепей включаются в секреторные гранулы и экзоцитозом поступают во внеклеточное пространство.
Внеклеточный этап начинается с частичного протеолиза специфическими пептидазами N- и С-концевых фрагментов. Образованный тропоколлаген состоит из 3-х равных по длине (~1000 ам-т) полипептидных цепей.
Внеклеточная модификация радикалов лизина идет под действием лизилоксидазы. Рис.11.11.
Е

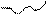 -NH-СН-СО- -NH-СН-СО-α-цепь в молекуле
-NH-СН-СО- -NH-СН-СО-α-цепь в молекуле
(СН2)4 (СН2)3тропоколлагена
NН2 О2 NH3 Н2О НС=О
Лизин Аллизин
Е - Лизилоксидаза (Си2+, РР, В6)
Фибриллогенез – объединение тропоколлагена в микрофибриллы.
Молекулы тропоколлагена самопроизвольно располагаются параллельными рядами. В каждом ряду может находиться несколько молекул тропоколлагена, расстояние между ними ~ 35нм. В параллельных рядах отдельные молекулы тропоколлагена смещены на ¼ относительно друг друга (67 нм). Структура фибрилл стабилизируется межмолекулярными ковалентными сшивками между радикалами лизина, аллизина, гидроксилизина или гидроксиаллизина Рис.11.12.
Рис.11.13.А.
Количество и тип сшивок зависит от прочности ткани на растяжение. Наибольшее количество сшивок в коллагене ахиллового сухожилия.
Прочность коллагеновых волокон обусловлена :
· водородными связями между пептидными цепями коллагена;
· образованием тройной спирали из полипептидных цепей;
· множеством ковалентных связей между молекулами тропоколлагена
· сдвигом молекул тропоколлагена на 1/4 относительно друг друга в микрофибрилле коллагена.
Коллагеновые микрофибриллы в различных тканях отличаются по:
• толщине;
• структурной организации.
Рис.11.14.
Типы коллагена.
Коллагены – полиморфные белки, которые кодируется 20 генами. В разных тканях экспрессируются различные комбинации этих генов. Коллагены I, II, III – фибриллярные белки, особенно широко распространен коллаген I типа.
Катаболизм коллагена.
Коллаген – медленно обменивающийся белок. Время его полужизни недели или даже месяцы. Коллагеназа гидролизует сразу три нити в между остатками глицина и лейцина (изолейцина). Рис.11.15.
По количеству гидроксипролина, выделяемого за сутки с мочой, можно судить об активности процесса катаболизма коллагена. У здорового человека за сутки экскретируется 15-50 мг гидроксипролина.
При старении:
· снижается скорость обмена коллагена;
· увеличивается количество поперечных связей между молекулами тропоколлагена, что делает их более жесткими и хрупкими;
· уменьшается соотношение ГАГ/коллаген;
· уменьшается количество связанной воды;
· увеличивается сухость кожи, изменяются механические свойства хрящей и сухожилий, понижается прозрачность роговицы глаза.
ЭЛАСТИН
Эластичность, необходимая для функционирования кровеносных сосудов, легких, связок и кожи обеспечиваетсяэластином матрикса.Структура молекулы кодируется только одним геном.
Особенности строения эластина:
· белок построен из 750 аминокислотных остатков;
· молекулы содержат много аминокислот с гидрофобными радикалами. Глицин, валин, аланин и пролин составляют 70% от общего количества аминокислот полипептида;
· в состав цепи входит небольшое количество гидроксипролина, совсем нет гидроксилизина и углеводных фрагментов;
· полимерные молекулы не имеют строго определенной конформации; при натяжении упорядоченность структуры возрастает.
Синтез эластина и формирование полимерных структур.
Мономерная форма эластина синтезируется на рибосомах и называется тропоэластин.
Во внеклеточном пространствелизилоксидаза катализирует образование радикалов аллизина на участках цепи имеющих определенную последовательность: -Лиз-Ала-Ала-Лиз- и
–Лиз-Ала-Ала-Ала-Лиз-.
Между остатками 4 остатками аллизина и лизина образуются десмозин (пиридинолин) или в похожий по структуре изодесмозин (изопиридинолин).
Структура десмозина Рис.11.16.
В образовании десмозина могут принимать участие две, три или четыре молекулы тропоэластина.
Рис.11.17.
Эластические волокона могут растягиваться и снова сжиматься в двух направлениях, подобно резине.
Кроме десмозинов в эластине встречаются поперечные сшивки лизиннорлейцина, образованные двумя радикалами лизина.
Катаболизм.эластина. Время полураспада эластина составляет около 75 лет. Протеолиз белка происходит под действием эластазы, которая также может гидролизовать коллаген, иммуноглобулины и другие белки.
АДГЕЗИВНЫЕ.БЕЛКИ Внеклеточный матрикс содержит адгезивные гликопротеины: фибронектин, ламинин, нидоген,
Фибронектин – образующий фибриллы гликопротеин, он состоит из двух субъединиц, которые свернуты в серию.глобулярных.доменов. Отдельные домены могут взаимодействовать с: другими молекулами фибронектина, коллагеном, гликозамингликанами, интегриновыми рецепторами клеток и ферментом трансглутаминазой. Фермент образует ковалентную связь между остатками глутамина и лизина двух молекул фибронектина, фибронектина и коллагена или фибронектина и.других.белков. Структура фибронектина. Рис.11.18.
Эндотелиальные клетки, секретируют адгезивный гликопротеин ламинин – основной белок базальных мембран. Он состоит из трех пептидных цепей: α-, β- и γ имеющих доменное строение. Строение ламинина Рис.11.19.
Домены ламинина связываются с: другими молекулами ламинина, интегринами,.протеогликанами.базальной.мембраны,.гликопротеинами клеточной поверхности и белком нидогеном. N-концевые группы ламинина могут связывать Са2+ и образовывать сетевидные структуры с помощью.Са-зависимого.взаимодействия.
| <== предыдущая лекция | | | следующая лекция ==> |
| Кризисы в развитии семьи: нормативные, ненормативные. | | | ОСОБЕННОСТИ СЕТЕЙ ГОРЯЧЕГО ВОДОСНАБЖЕНИЯ |
Дата добавления: 2015-12-16; просмотров: 630;
