Поверхностная энергия. Адсорбция
1. К поверхностным явлениям относят процессы, проходящие на границе раздела фаз.
К таким явления относятся явления адсорбции, адгезии, электрофорез, капиллярные явления и т.д. Все поверхностные явления определяются величиной поверхностной энергии. Что же это за энергия?
Рассмотрим систему, которая состоит из жидкости и газа. Свойства молекул в поверхностном слое и в объеме системы сильно отличаются между собой. Молекулы, находящиеся внутри жидкости, испытывают одинаковое воздействие со всех сторон, в результате равнодействующая этих сил равна нулю. Молекулы, которые находятся на границе раздела, испытывают неодинаковое притяжение со стороны жидкой и газообразной фазы.Поэтому они обладают особой энергией – поверхностной. Эта сила будет направлена внутрь жидкой фазы, перпендикулярно ее поверхности. Т.е. на все молекулы на поверхности жидкость/газ действует сила, направленная внутрь жидкой фазы, и поверхность жидкости всегда стремится сократиться. Наименьшую площадь поверхности (при одинаковом объеме) имеет сфера. Поэтому в невесомости капля любой жидкости принимает форму сферы. Но на Земле на тела действует сила тяжести и молекулы жидкости не могут не считаться с ней, капля становиться неправильной формы. Такие процессы протекают на любой границе раздела. Только поверхность твердого тела не может изменить свою форму из-за большой силы взаимодействия между частицами вещества.
Итак, всякая поверхность характеризуется запасом энергии, называемой поверхностной энергией. Для гетерогенной системы общая энергия системы будет определяться не только величиной тепловой, электрической и т.д. энергий. Но и величиной поверхностной энергии.
Различные физические явления, происходящие на поверхности раздела фаз, сопровождаются превращением этой энергии в другую. Например, в поверхностную энергию превращается работа, затрачиваемая на образование поверхности раздела (вы надуваете мыльный пузырь).
Величину поверхностной энергии определяют формулой 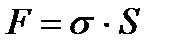 .Это значит, она зависит от площади поверхности (т.е. от того, сколько частиц находится на границе раздела и испытывают тот «дискомфорт» о котором мы говорили. Коэффициент пропорциональности -
.Это значит, она зависит от площади поверхности (т.е. от того, сколько частиц находится на границе раздела и испытывают тот «дискомфорт» о котором мы говорили. Коэффициент пропорциональности - (сигма) - это удельная поверхностная энергия, потому что
(сигма) - это удельная поверхностная энергия, потому что  =
=  , т.е. поверхностная энергия единицы площади. Измеряется она в Н/м. Она зависит от природы веществ, которые образовали границу раздела, т.е. от того, с какой силой частицу «тянут в разные стороны». Максимальное значение удельная поверхностная энергия имеет при контакте вещества с воздухом (или любым другим газом), т.е. когда на частицу действуют силы притяжения только, с одной стороны. Чистые жидкости имеют определенное значение удельной поверхностной энергии при определенной температуре, для жидкостей эту величину обычно называют поверхностным натяжением. Причем чем сильнее взаимодействуют частицы жидкости между собой, тем больше поверхностное натяжение. Бензол (неполярная жидкость) – 29 кН/м, Н2О (полярные молекулы) – 73 кН/м, а у Hg (металлическая связь) – 473·10-3). У растворов величина поверхностного натяжения зависит от природы растворенных веществ, их концентрации и др. факторов. Для твердых тел удельная поверхностная энергия значительно выше, однако она не поддается непосредственному измерению.
, т.е. поверхностная энергия единицы площади. Измеряется она в Н/м. Она зависит от природы веществ, которые образовали границу раздела, т.е. от того, с какой силой частицу «тянут в разные стороны». Максимальное значение удельная поверхностная энергия имеет при контакте вещества с воздухом (или любым другим газом), т.е. когда на частицу действуют силы притяжения только, с одной стороны. Чистые жидкости имеют определенное значение удельной поверхностной энергии при определенной температуре, для жидкостей эту величину обычно называют поверхностным натяжением. Причем чем сильнее взаимодействуют частицы жидкости между собой, тем больше поверхностное натяжение. Бензол (неполярная жидкость) – 29 кН/м, Н2О (полярные молекулы) – 73 кН/м, а у Hg (металлическая связь) – 473·10-3). У растворов величина поверхностного натяжения зависит от природы растворенных веществ, их концентрации и др. факторов. Для твердых тел удельная поверхностная энергия значительно выше, однако она не поддается непосредственному измерению.
2. Согласно законам термодинамики, любая система стремится иметь минимальную энергию, а значит и минимальную поверхностную энергию. Уменьшение свободной поверхностной энергии может происходить или за счет сокращения поверхности, или за счет уменьшения поверхностного натяжения.
Для чистых веществ возможен только первый вариант, поэтому такие гетерогенные системы термодинамически неустойчивы. В них самопроизвольно протекают процессы, в которых площадь границы раздела фаз уменьшается за счет слияния маленьких частиц в крупные. Именно по этой причине туман, эмульсии, насыщенные растворы с мелкими кристаллами и т.п. – системы неустойчивые, мелкие капли стремятся слиться друг с другом, а мелкие кристаллы растворяются и растут крупные.
В растворах уменьшение поверхностной энергии может происходить не только за счет уменьшения площади, но и за счет уменьшения поверхностного натяжения. Уменьшение поверхностного натяжения на поверхности растворов может происходить за счет адсорбции. Адсорбция – самопроизвольный процесс перехода растворенного вещества из объема фазы на границу раздела и увеличение концентрации растворенного вещества на границе раздела фаз. Вещества, адсорбция которых уменьшает поверхностное натяжение, называются поверхностно-активными (ПАВ). Вещества, которые не изменяют или увеличивают  поверхностное натяжение, называются поверхностно-инактивными.
поверхностное натяжение, называются поверхностно-инактивными.
Равновесие в системе определяется двумя процессами: притяжением молекул к поверхности под действием межмолекулярных сил и тепловым движением частиц, стремящимся восстановить равенство концентрации по всему объему раствора. Зависимость поверхностного натяжения растворов от концентрации веществ описывается σ = f(c). Если кривая поверхностного натяжения идет вниз – это ПАВ. Чем круче падает кривая, тем большей поверхностной активностью обладает ПАВ.
Характерной особенностью строения ПАВ является дифильность молекулы. Молекулы ПАВ состоят из двух частей – полярной группы ( -ОН, NH2-, -СООН и т.д.) и неполярного углеводородного радикала. Изображаются ПАВ обычно в виде «головастика», где «хвостик» - углеводородный радикал, а кружочек – полярная группа. 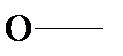 Полярная группа хорошо взаимодействует с водой, она и обусловливает гидрофильность молекулы ПАВ, т.е. ее способность к растворению в воде.
Полярная группа хорошо взаимодействует с водой, она и обусловливает гидрофильность молекулы ПАВ, т.е. ее способность к растворению в воде.
У неполярного радикала сродство к неполярной фазе. Это может быть и воздух, и неполярная жидкость, и неполярное твердое вещество. Поверхностная активность ПАВ (стремление ПАВ взаимодействовать с этой неполярной фазой) сильно зависит от длины углеводородного радикала. Правило Дюкло – Траубе: поверхностная активность веществ с увеличением углеродного радикала на группу СН2 повышается в 2-4 раза. Молекула, которая имеет дифильное строение, стремиться находиться на границе раздела фаз, т.е. так чтобы полярная часть молекулы была в полярной фазе, а неполярная часть молекулы – в неполярной фазе.Поэтому ПАВ выталкиваются из объема раствора на границу раздела фаз, происходит адсорбция. Электролиты взаимодействуют с молекулами воды хорошо, поэтому они уходят в глубь раствора, адсорбция не происходит. Такие вещества называются инактивными.
3. Уравнение Гиббса связывает величину адсорбции с концентрацией ПАВ и поверхностным натяжением.
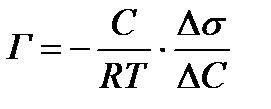 , где величина
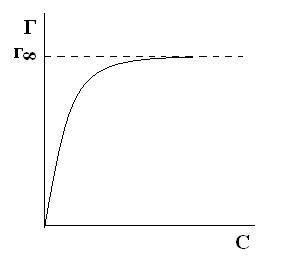
, где величина 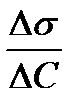 называется поверхностной активностью.При постоянной температуре уравнение Гиббса дает возможность построить изотерму адсорбции для данной системы, т.е. кривую Г = f(c).
называется поверхностной активностью.При постоянной температуре уравнение Гиббса дает возможность построить изотерму адсорбции для данной системы, т.е. кривую Г = f(c).
Обратите внимание: при малых концентрациях ПАВ адсорбция прямо пропорциональна С, а при высоких достигает предельного значения и дальше не меняется. Причем
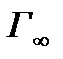 - постоянна для всех веществ данного гомологического ряда. Существование предельной величины Г
- постоянна для всех веществ данного гомологического ряда. Существование предельной величины Г 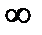 легко объясняется: поверхностный слой можно до предела заполнить молекулами ПАВ при высокой концентрации их в растворе. Для всех веществ одного гомологического ряда Г
легко объясняется: поверхностный слой можно до предела заполнить молекулами ПАВ при высокой концентрации их в растворе. Для всех веществ одного гомологического ряда Г 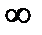 - величина постоянная, это означает, что на 1 см2 площади поверхностного слоя помещается одно и то же число молекул, независимо от длины радикала, значит молекулы не «лежат», а «стоят» на границе раздела фаз. Ленгмюр назвал этот феномен «принцип независимости поверхностного действия», т.е. при адсорбции дифильных молекул полярные группы втягиваются в воду (полярную фазу), а неполярные выталкиваются в неполярную фазу. При малых концентрациях ориентация молекул произвольна, а при высокой – молекулы приобретают вертикальное положение, и поверхность воды оказывается сплошь покрытой мономолекулярным слоем ПАВ - частокол Ленгмюра. Процесс адсорбции находится в динамическом равновесии с процессом десорбции.
- величина постоянная, это означает, что на 1 см2 площади поверхностного слоя помещается одно и то же число молекул, независимо от длины радикала, значит молекулы не «лежат», а «стоят» на границе раздела фаз. Ленгмюр назвал этот феномен «принцип независимости поверхностного действия», т.е. при адсорбции дифильных молекул полярные группы втягиваются в воду (полярную фазу), а неполярные выталкиваются в неполярную фазу. При малых концентрациях ориентация молекул произвольна, а при высокой – молекулы приобретают вертикальное положение, и поверхность воды оказывается сплошь покрытой мономолекулярным слоем ПАВ - частокол Ленгмюра. Процесс адсорбции находится в динамическом равновесии с процессом десорбции.
4. А как ведут себя молекулы ПАВ, которые не поместились на поверхности? Гидрофобный углеводородный радикал является причиной пониженной растворимости этих соединений в воде. Молекулы поворачиваются друг к другу неполярными радикалами и образуют так называемые мицеллы. Это крупные частицы, состоящие из множества молекул, ориентированных определенным образом. В результате на поверхности мицеллы находятся популярные группы с большим сродством к воде. В результате растворимость ПАВ значительно увеличивается. Только это уже не идеальные, а коллоидные растворы. Интересно, что в лиофобной (неполярной) части этих мицелл могут растворяться неполярные вещества, которые в воде вообще не растворяются. Этот процесс называется солюбилизация.
К ПАВ относятся: карбоновые кислоты и их соли, сульфокислоты, высшие спирты, белки и т.д. Многие органических веществ, входящих в состав живого организма, относятся к ПАВ. Они принимают участие во многих физиологических процессах. Например, на усвоение жира влияют соли желчных кислот, потому что они способствуют эмульгации жира, а в виде эмульсии жир усваивается лучше. ПАВ широко используются в фармакологии при изготовлении свечей, мазей, для стабилизации эмульсий, суспензий и в качестве солюбилизаторов. Солюбилизаторы используют при изготовлении водных препаратов жирорастворимых витаминов, гормонов и т.д. Принцип независимости поверхностного действия лежит в основе представления о биологических мембранах. В мембране имеются два слоя молекул фосфолипидов, которые гидрофильными концами направлены наружу, а гидрофобными «хвостиками» к центру мембран. На полярных группах фосфолипидов адсорбированы слои белков. Адсорбированные молекулы белков развертываются и становятся объектами ферментной атаки. Скорость реакции при этом увеличивается на несколько порядков. Продукты реакции вытесняются из пленки, уступая место новым белкам. Знание свойств ПАВ помогает изучению процессов, проходящих в организме и синтезе лекарственных препаратов. ПАВы широко используются в фармакологии для приготовления эмульсий, суспензий, они обязательно входят в состав моющих и дезинфицирующих средств.
Итак: среди процессов, происходящих на поверхности раздела фаз сорбционные явления имеют особое значение. Сорбция – это способность вещества поглощать другое вещество. Если сорбция происходит лишь в поверхностном слое – она называется адсорбцией. Именно о такой сорбции мы и говорили выше. Если сорбция идет по всему объему (это часто бывает, когда процесс идет на поверхности жидкости) – то она называется абсорбцией. То вещество, которое поглощает, называется сорбентом или адсорбентом. А то, которое поглощается – сорбтивом или адсорбтивом. Если взаимодействие между сорбентом и сорбтивом ограничиваются межмолекулярным взаимодействием, процесс называют физической сорбцией. Если в процессе образуются новые соединения, то процесс называется хемосорбцией. Но граница между этими процессами весьма условна.
5.Адсорбция на твердом адсорбенте протекает более сложно, чем на поверхности жидкости, потому что нельзя непосредственно измерить поверхностное натяжение и нельзя точно определить площадь поверхноститвердого вещества. Поэтому адсорбцию на твердых веществах выражают в молях адсорбтива на единицу массы адсорбента, а не на единицу площади поверхности, т.е.
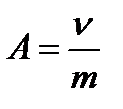
Характер адсорбционных явлений на поверхности твердого тела тоже немного отличается. Например,адсорбция происходит не равномерно по всей поверхности, а на активных центрах (участки поверхности твердого вещества с повышенной энергией).
Адсорбция газов на твердом веществе существенно зависит от температуры. Чем выше температура, тем меньше величина адсорбции, и участок плато на изотерме адсорбции находится ниже.
Если адсорбция происходит на границе твердое тело – раствор, то она осложнена наличием растворителя, который тоже может адсорбироваться и всегда взаимодействует с растворенным веществом.
Дата добавления: 2015-12-11; просмотров: 5594;
