Различают два вида адсорбции из раствора: молекулярную (неэлектролитов или слабых электролитов) и ионную (сильные электролиты).
Молекулярная адсорбция. Большое влияние на молекулярную адсорбцию оказывает взаимодействие растворителя и адсорбента. Различают гидрофильные поверхности твердых адсорбентов (взаимодействуют с растворителем, т.е. смачиваются водой: силикагели, глины) и гидрофобные (не смачиваются: уголь, тальк, парафин). П.А.Ребиндер сформулировал правило выравнивания полярности фаз: растворенное вещество тем лучше  адсорбируется, чем больше разность полярностей между адсорбентом и растворителем. Т.е. чтобы ПАВ адсорбировалось хорошо, надо чтобы твердый адсорбент и раствор были разными по природе и на границе раздела была бы значительная удельная поверхностная энергия. Тогда дифильным молекулам есть смысл стремиться на границу раздела. Естественно, что при адсорбции молекулы ПАВ на границе фаз будут ориентироваться определенным образом (см. принцип независимости поверхностного действия Ленгмюра), т.е. дифильные молекулы будут адсорбироваться так, чтобы полярная часть была обращена к полярой фазе, а неполярная к неполярной. Поверхность твердой фазы становится по полярности такой же, как и жидкая, они «выравниваются».
адсорбируется, чем больше разность полярностей между адсорбентом и растворителем. Т.е. чтобы ПАВ адсорбировалось хорошо, надо чтобы твердый адсорбент и раствор были разными по природе и на границе раздела была бы значительная удельная поверхностная энергия. Тогда дифильным молекулам есть смысл стремиться на границу раздела. Естественно, что при адсорбции молекулы ПАВ на границе фаз будут ориентироваться определенным образом (см. принцип независимости поверхностного действия Ленгмюра), т.е. дифильные молекулы будут адсорбироваться так, чтобы полярная часть была обращена к полярой фазе, а неполярная к неполярной. Поверхность твердой фазы становится по полярности такой же, как и жидкая, они «выравниваются».

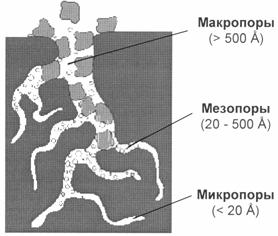 Отсюда следует, что ПАВ из водных растворов должны адсорбироваться на гидрофобных поверхностях, а ПАВ растворенные в неполярных растворителях адсорбируются на гидрофильных адсорбентах. Если же для водного раствора взять гидрофильный адсорбент, то адсорбироваться будет вода, а не растворенное вещество. Например: для очистки спирта от сивушных масел используют уголь, а для очистки нефти от электролитов – силикагель. Кроме этого надо учитывать, что адсорбция очень сильно зависит от природы вещества-адсорбтива (ПАВ адсорбируются лучше, чем неполярные молекулы) и увеличивается с увеличением молекулярной массы вещества. Величина поверхностной энергии на границе адсорбент –раствор зависит не только от природы веществ, но и от площади поверхности, т.е. пористости и степени измельченности адсорбента. Такие адсорбенты имеют удельную поверхность порядка сотен квадратных метров на 1 г. Пористые адсорбенты применяют в виде гранул или таблеток. В качестве пористых адсорбентов наиболее часто применяются активированный уголь, силикагель, природные силикаты (глины), алюмогель, алюмосиликаты.
Отсюда следует, что ПАВ из водных растворов должны адсорбироваться на гидрофобных поверхностях, а ПАВ растворенные в неполярных растворителях адсорбируются на гидрофильных адсорбентах. Если же для водного раствора взять гидрофильный адсорбент, то адсорбироваться будет вода, а не растворенное вещество. Например: для очистки спирта от сивушных масел используют уголь, а для очистки нефти от электролитов – силикагель. Кроме этого надо учитывать, что адсорбция очень сильно зависит от природы вещества-адсорбтива (ПАВ адсорбируются лучше, чем неполярные молекулы) и увеличивается с увеличением молекулярной массы вещества. Величина поверхностной энергии на границе адсорбент –раствор зависит не только от природы веществ, но и от площади поверхности, т.е. пористости и степени измельченности адсорбента. Такие адсорбенты имеют удельную поверхность порядка сотен квадратных метров на 1 г. Пористые адсорбенты применяют в виде гранул или таблеток. В качестве пористых адсорбентов наиболее часто применяются активированный уголь, силикагель, природные силикаты (глины), алюмогель, алюмосиликаты.
Древесный уголь обычно имеет небольшую адсорбционную способность, т.к. его удельная поверхность сравнительно невелика, поры заполнены смолами. Активирование угля заключается в его термической обработке перегретым водяным паром, в результате которой удельная поверхность увеличивается, т.к. продукты неполного сгорания улетучиваются. Активированный уголь как адсорбент применяется для очистки растворителей, воздуха, воды. В медицинской практике его назначают при отравлениях, для поглощения избытка газов в кишечнике, используют в гемодиализе.
Силикагель – гидратированный оксид кремния, приготовленный в виде пористого тела или порошка. Силикагель отличается от угля меньшей адсорбционной способностью при низком давлении и способностью избирательно поглощать пары воды. Поэтому его обычно применяют для осушки газов. Широко применяются в виде адсорбентов, т.н. молекулярные сита. Примером таких сит являются цеолиты (алюмосиликаты), они задерживают малые молекулы, а большие молекулы в рыхлую структуру цеолита проникнуть не могут. На этом основано использование молекулярных сит для разделения газов, растворов и т.д.
Сильные электролиты в растворах полностью диссоциированы на заряженные частички – ионы, и при адсорбции сильных электролитов надо учитывать не только адсорбционные, но и электростатические силы. «Подобное к подобному». Ионы хорошо адсорбируются только на полярных адсорбентах. Кроме того, адсорбция ионов носит обменный характер и характеризуется высокой избирательностью.
Обменный характер ионной адсорбции заключается в том, что, поглощая из раствора какие-то ионы, адсорбент отдает в раствор эквивалентное количество других ионов, потому что заряд раствора и адсорбента при адсорбции меняться не может.Ионный обмен между раствором и адсорбентом носит избирательный характер, т.е. сильно зависит от природы адсорбента и адсорбируемых ионов, равновесие всегда сдвинуто в сторону образования менее растворимых соединений. В чем-то этот процесс похож на реакции ионного обмена, но протекает исключительно на поверхности чистого адсорбента.
Неорганические и органические материалы, способные к обмену ионами с раствором, получили название ионитов. Их делят на катиониты и аниониты. Иониты выпускают в виде зернистых порошков, волокон и мембран. Они не растворимы в воде, но в их состав входят группы атомов, несущие заряд (они называются потенциалопределяющими). С этими группами связаны электростатическими силами ионы противоположного знака, которые способны к обмену на другие ионы. Ионообменный процесс обратим.
R-H + NaCl  R-Na + HCl
R-Na + HCl
Правило избирательной адсорбции (правило Пескова-Фаянса): на поверхности твердого вещества преимущественно адсорбируются ионы способные достраивать его кристаллическую решетку (т.е. имеющиеся в составе решетки либо изоморфные им).
Например: в системе AgNO3+ KI = AgI↓ +KNO3 на кристаллах осадка AgI будут адсорбироваться в первую очередь ионы Ag+ и I- .
Дата добавления: 2015-12-11; просмотров: 3272;
