ОПТИЧЕСКАЯ ИЗОМЕРИЯ
Изучение гидроксикислот имело исключительно большое значение для развития науки о пространственном строении молекул – стереохимии. Особенностью пространственного строения многих гидроксикислот является наличие атома углерода, имеющего четыре различных заместителя. Например, молочная кислота:
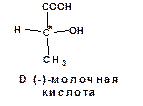
Такие атомы называются ассимметрическими углеродными атомами или хиральными (хиральными центрами). В формулах асимметрические углеродные атомы обозначаются звездочкой.
Молекулы, имеющие асимметрические углеродные атомы, могут быть представлены в виде двух пространственных изомеров, различающихся как предмет и его зеркальное отображение:
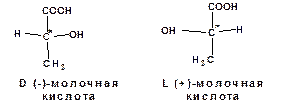
Изомеры, отличающиеся друг от друга только расположением атомов в пространстве, называются стереоизомерами. Расположение атомов, характеризующее определенный стереоизомер, называется конфигурацией. Стереоизомеры, различающиеся как предмет и его зеркальное отражение называются энантиомерами. Энантиомеры являются оптически активными веществами – они способны вращать плоскость поляризации света. Причем из пары энантиомеров один вращает плоскость поляризации вправо. Такой изомер называется правовращающим и обозначается знаком «(+)». Другой изомер вращает плоскость поляризации влево. Такой изомер называется левовращательным и обозначается знаком «(-)». Изомеры, отличающиеся только знаком вращения называются оптическими антиподами.
При изображении оптически активных соединений пользуются проекционными формулами, представляющих собой проекции тетраэдрических моделей соответствующих молекул на плоскость чертежа:
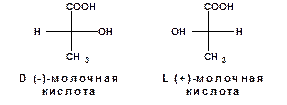
При изображении проекционных формул принимается, что группы, расположенные сверху и снизу, находятся за плоскостью чертежа, а группы, расположенные слева и справа - перед плоскостью чертежа. Поэтому формулы нельзя поворачивать в плоскости чертежа на 900 и можно поворачивать на 1800. Например:
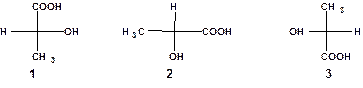
Соединения 1 и 2 являются оптическими антиподами, поскольку 2 получено путем поворота 1 на 900. Формула 3 получена из 1 поворотом на 1800, поэтому 3 эквивалентно 1.
Для направления и величины вращения плоскости поляризации не существует определенных закономерностей взаимосвязи со строением оптически активных соединений. Можно отмечать как факт, что молочная кислота, содержащаяся в мышцах, вращает плоскость поляризации вправо и известна как правовращающая (+). Также как факт принимается то, что молочная кислота, образующаяся при брожении сахарозы, в присутствии бактерий, вращает плоскость поляризации влево и называется левовращающей (-).
Какими–либо химическими методами невозможно установить, как в молекулах оптических изомеров атомы расположены относительно друг друга. Т.е. химически невозможно установить какова природная или абсолютная конфигурация оптически активного вещества. Впервые ученые смогли это установить только в 1949 году физическим методом рентгеноструктурного анализа.
До этого момента химики могли ограничиться только установлением конфигурации оптически активных веществ относительного какого-либо оптически активного вещества, принятого за стандарт. Так называемая относительная конфигурация. Основой для такого подхода было то, что можно провести превращение вещества, принятого за стандарт, в интересующее вещество таким образом, чтобы конфигурация асимметрического атома углерода не нарушалась.
В 1906 году в качестве стандарта был избран глицериновый альдегид, поскольку он является простейшим полигидроксикарбонильным соединением, способным к оптической изомерии. Правовращающему глицериновому альдегиду была приписана следующая конфигурация, обозначенная как «D»:
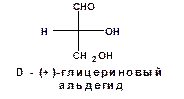
Соответственно его оптическому антиподу была приписана следующая конфигурация и обозначена как «L»:
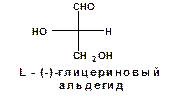
В 1951 году методами рентгеноструктурного анализа было показано, что выбранная наугад абсолютная конфигурация глицеринового альдегида оказалась правильной.
По абсолютной конфигурации глицеринового альдегида были установлены относительные конфигурации других оптически активных веществ. Так относительная конфигурация молочной кислоты была установлена по D-(+)-глицериновому альдегиду следующим образом:
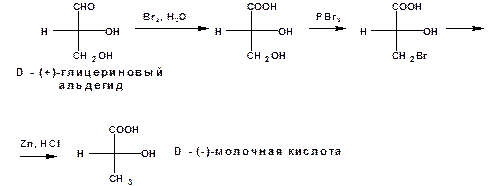
Окислением альдегидной группы в карбоксильную и восстановлением гидроксиметиленовой группы в метильную было установлено, что D-конфигурации соответствует левовращающая молочная кислота.
Подобным образом были установлены относительные конфигурации многих веществ.
Так для оптически активной яблочной кислоты, вращающей плоскость поляризации вправо, установлена следующая конфигурация относительно D-(+)-глицеринового альдегида:
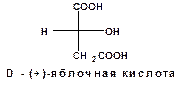
При обработке D-(+)-яблочной кислоты пятихлористым фосфором получается L-(-) хлорянтарная кислота:
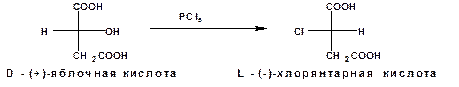
Т.е. при этом произошло обращение конфигурации.
Если на L-(-) хлорянтарную кислоту подействовать влажной окисью серебра то получается L-(-)-яблочная кислота:
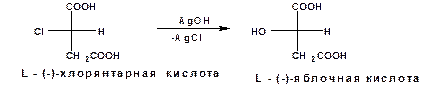
Однако если яблочную кислоту получить присоединением воды к фумаровой или малеиновой кислоте то получается продукт, не обладающий оптической активностью:
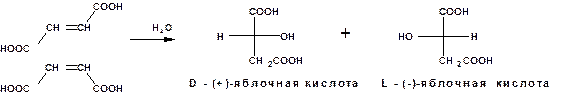
Так как строение яблочной кислоты обуславливает обязательную оптическую активность, то в случае гидратации непредельных кислот получается смесь равных количеств двух оптических изомеров.
Совокупность равных количеств энантиомеров называется рацемической модификацией или рацематом.
Рассмотренные три случая различаются по механизмам образования продуктов. Рацемическая модификация образуется в том случае если реакция протекает через стадию устойчивого карбкатиона, атака которого возможна с двух сторон.
Если атака карбкатиона возможна только с одной стороны, то продукт сохраняет конфигурацию. Такой случай возможен в дикарбоновых кислотах, где за счет взаимодействия карбоксильных групп доступ к реакционному центру возможен только с одной стороны.
При нуклеофильном замещении, протекающим по механизму SN2, происходит обращение конфигурации. Так называемое Вальденовское обращение.
Усложнение строения оптически активных веществ стало требовать систематизации обозначений конфигурации. Была введена так называемая R, S система. Согласно этой системе, сначала определяют старшинство, или последовательность заместителей, связанных асимметрическим атомом, исходя из правил старшинства.
1. Если с асимметрическим атомом углерода связаны четыре различных атома, то старшинство определяется порядковым номером в таблице Менделеева, чем больше номер, тем старше заместитель.
2. Если старшинство нельзя определить по первым атомам, связанным с асимметрическим атомом, то старшинство аналогично определяют по вторым атомам и т.д.
3. Если атомы, связанные с асимметрическим атомом углерода, имеют разное количество заместителей, построенных из атомов с одинаковым порядковым номером, то старшим - является атом, имеющий большее число заместителей.
4. Если атом соединен двумя или тремя связями, то его считают за два атома. Из этого следует, что СООН старше СНО и СНО старше СН2ОН.
После определения старшинства молекулу располагают таким образом, чтобы самая младшая группа была направлена от наблюдателя, и рассматривают расположение оставшихся групп. Если старшинство убывает по часовой стрелке, то конфигурацию обозначают символом «R»- от латинского «правый». Если старшинство убывает против часовой стрелки, то конфигурацию обозначают символом «S» -от латинского «левый».
При этом R, S - система отражает абсолютную конфигурацию асимметрического атома углерода. Согласно этой системе энантиомеры глицеринового альдегида будут обозначены следующим образом:
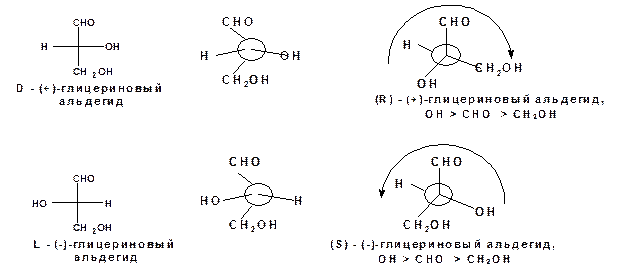
Полное название оптически активного соединения отражает конфигурацию и направление вращения. Рацемическую модификацию можно обозначать символом (R, S), например (R,S)-яблочная кислота.
Каждому асимметрическому атому углерода соответствуют два антипода и один рацемат. Общая формула количества оптических изомеров N =2n, где n – число асимметрических атомов углерода. Однако для дигидроксиянтарной кислоты, имеющей два хиральных центра:
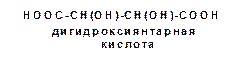
наблюдается аномалия.
Дигидроксиянтарные кислоты называются винными кислотами. Оптически активные изомеры винной кислоты можно изобразить следующими проекционными формулами:
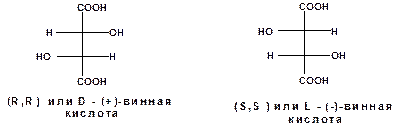
Рацемическая смесь винных кислот (R,S)-винная - называется виноградной кислотой. (+)-Винная кислота называется еще виннокаменной содержится в соке ягод. Ее калийная соль выделяется в виде винного камня при брожении виноградного сока. (-)-Винную кислоту получают из виноградной кислоты.
Приведенные примеры говорят о двух изомерах и одном рацемате. По формуле должны быть еще два изомера. Этим изомерам должны соответствовать следующие проекционные формулы:
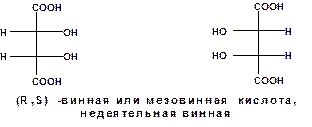
Если одну из проекционных формул мезовинной кислоты повернуть на 1800, то проекции совместятся. Т.е. формулы представляют один и тот же стереоизомер. Его особенностью является то, что вращение, вызываемое одним асимметрическим атомом углерода - компенсируется вращением в противоположную сторону, обусловленное другим атомом углерода.
В данном случае оптическая неактивность стереоизомера обусловлена симметрией молекулы.
При этом мезовинная кислота не является зеркальным отображением винных кислот. Стереоизмеры, не являющиеся зеркальным отображением, называются диастереомеры.
Дата добавления: 2015-12-08; просмотров: 3625;
