Попутный нефтяной газ.
Попутный нефтяной газ, свое название получил за счет того, что скапливается в виде «шапки» над нефтяным пластом.
Имеет состав, как и природный газ, но с более высоким содержанием этана, пропана, бутана, пентана.
Применяется как химическое сырье. Применение основано на разделении газа на составные части (фракции).
Из нефтяного попутного газа извлекают:
1. этан, пропан, бутан – используют для получения непредельных углеводородов, спиртов, полимеров, каучуков,
2. метан – используют для получения сажи, водорода, ацетилена,
3. пентан, гексан – из данных компонентов получают «газовый бензин», который используют в автотранспорте.
Нефть.
Нефть – черная маслянистая жидкость, горюча, не растворима воде. Нефть не имеет химической формулы, т. к. это смесь различных углеводородов. В состав нефти входят предельные углеводороды, циклопарафины, ароматические соединения, органические соединения, содержащие кислород, серу, азот; различные смолы.
Нефть разделяют на фракции для получения различных нефтепродуктов, для этого используют прямую перегонку нефти, (нефть нагревают и выделяют различные углеводороды). При прямой перегонке нефти получают моторное топливо:
Светлые нефтепродукты: бензин (С5 – С11), лигроин (С5 – С14),
керосин (С12 – С18), газойль (С15 – С20) – используют как моторное топливо.
Темные нефтепродукты: мазут (С22 и выше) – используют в дальнейшей переработке.
Мазут в дальнейшем перерабатывают, подвергая процессу крекинга.
Крекинг был открыт русским инженером В. П. Шуховым в 1891 году и заключается в получении светлых нефтепродуктов из мазута.
Крекинг бывает двух видов: термический (пиролиз) и каталитический.
1. Термический крекинг идет при высокой температуре, с малой скоростью. В результате крекинга получаются непредельные углеводороды.
2. Каталитический крекинг идет в присутствии катализатора, при низкой температуре, с высокой скоростью. В результате каталитического крекинга получаются непредельные углеводороды.
Процессы крекинга.
Процесс крекинга идет по свободно – радикальному механизму.
| С16Н34 = С8Н18 + С8 Н16 | С4Н10 = С2Н6 + С2Н4 |
| С8Н18 = С4Н10 + С4Н8 | С4Н10 = С3Н6 + СН4 |
В процессе крекинга происходит изомеризация – превращение углеводородов нормального строения в разветвленное, риформинг – ароматизация бензинов. Данные процессы разработаны для улучшения бензина.
Из нефти получают ароматические углеводороды. Гексан каталитически превращают в циклогексан, который дегидрируется в бензол. В настоящее время из нефти получают более 90% всех органических соединений. В основе этого производства лежит превращение содержащихся в нефти углеводородов в ненасыщенные углеводороды, как, например, в этен, пропен, бутены, арены. Эти реакционно-способные углеводороды служат исходным сырьем для большинства синтезов.
Задание № 1. «Расчеты по химическим уравнениям».
1. Какая масса гидроксида натрия необходима для нейтрализации 39,2 г серной кислоты?
2. Какая масса хлорида натрия образуется при нейтрализации 16 г гидроксида натрия избытком соляной кислоты?
3. Какое количество вещества магния реагировало с избытком соляной кислоты, если в ходе реакции выделилось 4,48 л водорода.
4. Какой объем аммиака необходим для получения 21,4 г хлорида аммония, при взаимодействии аммиака с избытком соляной кислоты.
5. Сколько граммов оксида серы (1У) образуется при сжигании 10 г технической серы, содержащей 95% чистой серы, если выход реакции составляет 90%?
6. Какой объем оксида углерода (1У) образуется при разложении 1 кг известняка, содержащего 90% карбоната кальция, если выход этой реакции составляет 85%?
7. Определите массу соли, образующейся при взаимодействии 10 г гидроксида натрия и 10 г азотной кислоты.
8. Сколько граммов хлорида аммония образуется при взаимодействии 5,6 л аммиака и 7,3 г хлороводорода?
9. Сколько граммов карбоната кальция необходимо подвергнуть термическому разложению, чтобы выделившийся углекислый газ образовал с избытком гидроксида бария осадок массой 9,85 г, если выход реакции разложения карбоната кальция равен 90%, а выход реакции взаимодействия углекислого газа с гидроксидом бария равен 95%?
10. Сколько граммов цинка должно реагировать с избытком раствора соляной кислоты, чтобы выделившийся водород восстановил 4 г оксида меди (П) до металлической меди? Считать, что для осуществления последней реакции необходим двукратный избыток водорода.
11. К 159 мл 10,0% раствора хлорида кальция (ρ = 1,05 г/мл) добавлено 47 мл 25,0% карбоната натрия (ρ = 1,08 г/мл).Определить массовую долю и молярную концентрацию соединений, содержащихся в растворе после завершения реакции, если плотность конечного раствора (ρ = 1,029 г/мл).
12. В двух стаканах находится по 100 г раствора с массовой долей соляной кислоты 25%. В один стакан добавили 10 г карбоната кальция, в другой – 8,4 г карбоната магния. Как будет различаться масса содержимого двух стаканов после завершения реакции? Какова массовая доля солей в полученных растворах?
13. В сосуд (объем 5,5 л) поместили углеводород, относящийся к классу алканов, массой 5 г. Затем в реактор ввели 4,48 л кислорода (н у). После полного сгорания углеводорода давление внутри реактора при температуре 2270 С составило 360 кПа. Определите формулу алкана.
Задание № 2. «Расчеты по химическим формулам. Определение формулы органического вещества».
1. Определите массовую долю азота в соединении: C6H5NH2.
2. Определите массовую долю кристаллизационной воды в медном купоросе CuSO4*5H2O.
3. При разложении 24,5 г соединения выделился кислород, занимающий при (н.у.) 6,72 л. Полученное после разложения соединение содержит 52,35% калия и 47,65% хлора. Определите простейшую формулу исходного соединения.
4. При сжигании 12 г органического соединения образовалось 14,4 г воды и углекислый газ, при пропускании которого в раствор гидроксида кальция образовалось 60 г осадка. Определите истинную формулу исходного соединения, если относительная плотность его паров по воздуху равна 2,069.
5. Углеводород содержит 82,76% углерода. Определите формулу этого вещества, если 1 л его паров при н. у. имеет массу 2,59 г.
6. Вещество «А» содержит в своем составе только углерод (83,35% по массе) и водород. Определите вещество «А».
7. При сгорании вещества массой 8,5 г образовались углекислый газ массой 26,4 г и вода массой 11,7 г. Плотность паров вещества по воздуху равна 5,862. Определите формулу вещества.
8. Может ли химическое соединение содержать 25% водорода? Если оно существует, то какова его химическая формула, исходя из основных положений теории А. М. Бутлерова.
9. Углеводород содержит 85,71% углерода. Образец этого соединения массой 22,4 г занимает объем 8,96 л. Определите химическую формулу этого соединения и составьте его структурную формулу.
10. Для сгорания 2 моль вещества потребовалось 4,5 моль кислорода и образовалось 2 моль углекислого газа, 1 моль азота и 5 моль воды. Установите формулу неизвестного вещества.
11. Установите формулу соединения, при сжигании 4,80 г которого было получено 2,88 г воды, 896 мл углекислого газа и 1,12 г азота.
Задание № 3. «Классификация органических соединений. Определение химических формул».
1. Приведите формулы пяти углеводородов, не имеющих изомеров.
2. Приведите примеры хлорпроизводных этана, которые имеют и не имеют изомеры.
3. Рассчитайте массу одной молекулы пропана. Определите относительную плотность пропана по аргону. Как нужно расположить сосуд для приема пропана вверх дном или вниз? Ваш ответ подтвердите расчетом.
4. В каком количестве вещества углекислого газа содержится столько же атомов углерода, сколько их содержится в 5,6 л этана (н. у.)?
5. Смесь 11,2 л метана и водорода имеет массу 5,5 г. Определите объемную и массовую доли метана в этой смеси.
6. Рассчитайте, одинаковое ли количество молекул содержится: а) в 5 г пропана и бутана, б) в 5 л пропана и бутана?
7. Определите массовую долю азота в соединении: C6H5NH2.
8. При сжигании 12 г органического соединения образовалось 14,4 г воды и углекислый газ, при пропускании которого в раствор гидроксида кальция образовалось 60 г осадка. Определите истинную формулу исходного соединения, если относительная плотность его паров по воздуху равна 2,069.
9. Углеводород содержит 82,76% углерода. Определите формулу вещества, если 1 л его паров при (н. у.) имеет массу 2,59 г.
10. Вещество «А» содержит в своем составе только углерод (83,35% по массе) и водород. Определите вещество «А».
11. При сгорании вещества массой 8,5 г образовались углекислый газ массой 26,4 г и вода массой 11,7 г. Плотность паров вещества по воздуху равна 5,862. Определите формулу вещества.
12. Может ли химическое соединение содержать 25% водорода? Если оно существует, то какова его химическая формула, исходя из основных положений теории А. М. Бутлерова.
13. Углеводород содержит 85,71% углерода. Образец этого соединения массой 22,4 г занимает объем 8,96 л. Определите химическую формулу этого соединения и составьте его структурную формулу.
14. Для сгорания 2 моль вещества потребовалось 4,5 моль кислорода и образовалось 2 моль углекислого газа, 1 моль азота и 5 моль воды. Установите формулу неизвестного вещества.
15. Установите формулу соединения, при сжигании 4,80 г которого было получено 2,88 г воды, 896 мл углекислого газа и 1,12 г азота.
Задание № 4. Классификация органических соединений.
1. Приведите формулы пяти углеводородов, не имеющих изомеров.
2. Приведите примеры хлорпроизводных этана, которые имеют и не имеют изомеры.
3. Нафталин представляет собой конденсированную систему, состоящую из двух бензольных колец. Сколько может быть изомерных дихлорнафталинов? Напишите структурные формулы всех изомеров.
4. Определите в углеводороде: СН3–СН=СН–С≡СН вид гибридизации атома углерода. Нарисуйте пространственное расположение сигма и пи орбиталей.
5. Рассчитайте массу одной молекулы пропана.
6. Определите относительную плотность газа этана по аргону.
7. Вам в лаборатории необходимо получить газ бутан (С4Н10). Как нужно расположить сосуд для приема газа вверх дном или вниз. Ваш ответ подтвердите расчетом.
8. Определите давление, при котором 1 г метана при 1000С займет объем 2 л.
9. В каком количестве вещества углекислого газа содержится столько же атомов углерода, сколько их содержится в 5,6 л этана (н у)?
10. Сколько молекул пропана содержится в 10 мл этого газа при температуре 270С и давлении 20 кПа?
11. Составьте термохимическое уравнение на основе следующих данных: при сжигании метана объемом 0,002 м3 выделяется 80,1 кДж теплоты. Рассчитайте, сколько теплоты выделится при сжигании 1000 м3 ставропольского природного газа, в котором объемная доля метана составляет 98%, условно полагая, что другие компоненты природного газа не горючи.
12. Смесь 11,2 л метана и водорода имеет массу 5,5 г. Определите объемную и массовую доли метана в этой смеси.
13. В каком количестве вещества гидрокарбоната кальция содержится столько же атомов углерода, сколько их содержится в 13,44 л пропана?
14. Рассчитайте, одинаковое ли количество молекул содержится:
а) в 5 г пропана и бутана, б) в 5 л пропана и бутана?
Задание № 5. «Химическая связь. Электронные эффекты».
1. Формула метилового спирта СН3ОН. Сравните кислотные свойства метилового спирта с водой, учитывая, что радикал – СН3 более электродонорный, чем водород.
2. Хлорметан (СН3Cl) и метан могут вступать в реакцию замещения с хлором. Объясните, какое из веществ в данную реакцию будет вступать легче. Почему?
3. Как произойдет процесс перераспределения электронной плотности в молекуле бромэтана (CH3-CH2-Br). Укажите, на каком атоме будет избыток электронной плотности. Почему? Укажите вид индукционного эффекта.
4. Как можно объяснить тот факт, что хлоруксусная кислота (Cl-CH2-COOH) обладает большими кислотными свойствами, чем уксусная (CH3-COOH)?
5. Составьте электронные формулы строения пропана и диметилового эфира. Какое существенное различие, не обнаруживаемое в обычных структурных формулах, показывают электронные формулы?
6. Как распределяются частичные заряды в связях: C – H, C – O, C – N,
C – Li, C – Cl. Где наблюдается положительный, а где отрицательный индукционный эффект? Укажите соответствующие знаки частичных зарядов.
7. Напишите сокращенные структурные формулы ближайших гомологов пропана, этилена, ацетилена, имеющих на два углеродных атома больше. Как произойдет перераспределение электронной плотности в данных гомологах.
8. Опишите пространственное строение следующих молекул: этана, этилена, ацетилена. Нарисуйте пространственное расположение орбиталей.
9. В чем заключается сущность донорно-акцепторного механизма образования химической связи? Приведите примеры неорганических соединений (не менее 3-х), связь в которых образована по этому механизму.
10. Приведите примеры органических соединений, в которых может возникать мезомерный эффект. Укажите, где он будет положительным, а где отрицательным.
11. Какие виды сопряжений будут возникать в следующих молекулах органических веществ: а) СН2=СН-СН=СН2, б) СН3-СН=СН2. Напишите для структуры (а) мезомерную формулу.
12. При нормальных условиях 1 л газообразного вещества, состоящего из углерода, водорода и кислорода, весит 2,05 г и при сжигании дает 3,95 г углекислого газа и 2,44 г воды. Рассчитайте молекулярную формулу вещества.
Задание повышенной сложности. «Теория электронных смещений. Индукционный и мезомерный эффекты».
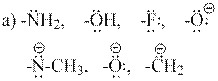
1. Укажите виды индукционного эффекта (+ I, – I) в следующих соединениях, проставьте возникающие при этом заряды.
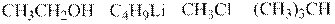
2. Расположите приведенные ниже соединения в порядке убывания индукционного эффекта:
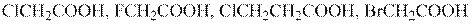
3. Сравните кислотные свойства следующих соединений с учетом индукционных эффектов групп, присоединенных к карбоксильной ( – СООН) группе
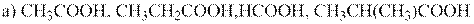
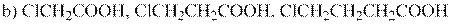
4. Сравните частичный положительный заряд на выделенных атомах углерода в следующем ряду соединений: H3C-Cl; H3C-NH2; H3C-F; H3C-OH;
H3C-CH2-Cl; H3C-CH2-OH.
5. Отметьте, в каких случаях возможно образование единой сопряженной системы и мезомерный эффект:
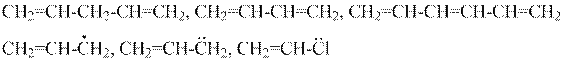
6. Сопоставьте силу мезомерного эффекта:
7. Приведите граничные структуры и мезоформулы с изогнутыми стрелками и выровненными связями для указанных соединений. Для каждого случая нарисуйте схемы π – связей двух граничных структур на выбор.
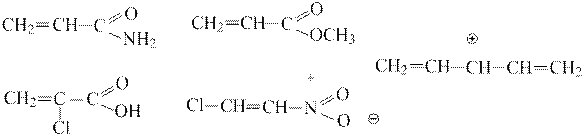
8. Положительный заряд на выделенном атоме углерода в молекуле
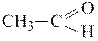 больше, чем в молекуле
больше, чем в молекуле 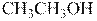 ?
?
9. В ниже приведенных соединениях определите все виды I- и М- эффектов. Приведите мезоформулы соединений и проставьте частичные положительные и отрицательные заряды.
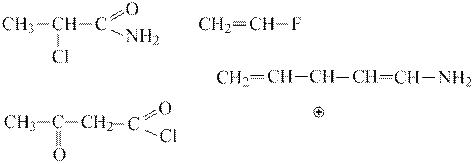
10. Объясните следующие явление:
а) почему невозможно сосуществование винилового спирта (СН2=СН–ОН)?
б) почему нитрометан может сосуществовать в виде кислоты

Дата добавления: 2015-11-06; просмотров: 1902;
